Assistance circulatoire mécanique percutanée
5 mai 2023
Par

Nous vous proposons de découvrir un extrait de l'ouvrage Urgences et Soins Intensifs de Cardiologie S’ouvre dans une nouvelle fenêtre
Assistance circulatoire mécanique percutanée (à court terme)
Holger Thiele et Pascal Vranckx
Thiele Holger, Heart Center Leipzig at University of Leipzig, Department of Internal Medicine/ Cardiology, Leipzig, Allemagne. Vranckx Pascal, Cardiac ITU, Virga Jesse Ziekenhuis, Hasselt, Belgique.

Résumé
Une assistance circulatoire mécanique percutanée (intervention coronarienne percutanée ou ICP) peut être utilisée pour réanimer les patients, comme mesure stabilisatrice pour une angiographie et une revascularisation rapide, ou comme une solution d'attente jusqu'à ce que des décisions thérapeutiques puissent être prises. En outre, il existe des preuves expérimentales que la décharge ventriculaire gauche peut réduire considérablement la taille de l'infarctus. Différents systèmes d'assistance circulatoire mécanique sont disponibles pour la communauté médicale. Les options de traitement par une assistance circulatoire mécanique doivent être adaptées à chaque patient afin de maximiser les avantages potentiels et de minimiser le risque d'effets délétères. La contre-pulsion par ballonnet intra-aortique (CPBIA) reste la méthode d'assistance circulatoire mécanique la plus largement utilisée. La facilité et la relative rapidité avec lesquelles ce dispositif peut être mis en place ont conduit à son utilisation généralisée comme intervention de première ligne chez les patients extrêmement instables à une époque où le niveau de preuve requis pour l'introduction de nouveaux dispositifs n'était pas aussi rigoureux qu'aujourd'hui. Lorsqu'un soutien hémodynamique plus important est nécessaire, un triage immédiat vers une assistance circulatoire mécanique percutanée (de court terme) plus avancée peut être justifié. Bien que ces dispositifs d'assistance circulatoire mécanique soient très largement employés, leur utilité reste incertaine dans les syndromes d'insuffisance cardiaque aiguë et le choc cardiogénique. Ce chapitre se concentre sur les utilisations d'assistance circulatoire mécanique utiles pour le cardiologue interventionnel et le médecin de soins intensifs cardiaques.
Introduction
La coronaropathie est aujourd'hui le facteur étiologique prédominant dans les syndromes d'insuffisance cardiaque aiguë (SICA) et le choc cardiogénique (voir aussi chapitres 19 et 20). La prise en charge invasive des patients cardiaques complexes présentant une insuffisance cardiaque avancée (décompensée), un choc cardiogénique et/ou une hémodynamique compromise pendant et après une intervention coronarienne percutanée (ICP) est devenue la compétence de centres de cardiologie interventionnelle spécialisés. Ces centres offrent des installations de pointe pour l'ICP, y compris des opérateurs expérimentés et des médecins de soins intensifs qui sont disponibles 24 heures par jour, 7 jours par semaine, avec un accès immédiat à la chirurgie cardiaque et aux systèmes d'assistance circulatoire mécanique (mechanial cardiac support ou MCS). Il existe deux indications principales de MCS (à court terme) :
pour réanimer les patients : assurer la perfusion des organes cibles en cas d'incapacité du cœur à répondre aux exigences métaboliques de l'organisme (voir chapitres 19 et 25), gagner du temps jusqu'à une intervention définitive, et la correction de la pathologie sous-jacente, et donc potentiellement pour améliorer la survie [1–3];
comme mesure stabilisatrice pour une angiographie et une revascularisation (rapide) : pour corriger les anomalies transitoires de la perfusion des organes cibles et de la fonction cardiaque et pour permettre à la fonction cardiaque d'origine de récupérer immédiatement après la procédure ou dans les suites immédiates (≈ 72 heures) [4].
De plus, il existe des preuves expérimentales que la décharge du ventricule gauche (VG) peut réduire considérablement la taille de l'infarctus et influencer le remodelage myocardique post-infartcus. Il a été démontré que la décharge mécanique du myocarde pendant l'ischémie et la reperfusion réduisait le travail en pression et la consommation d'O2 myocardique du VG. La réduction de la taille de l'infarctus a été corrélée au degré de décharge en pression du VG [5].
Considérations générales
Conception, exigences de performance et problèmes de sécurité
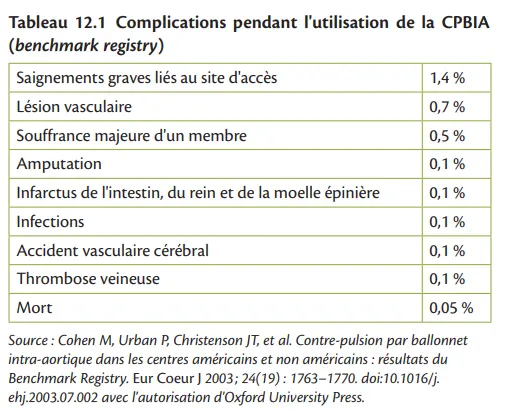
La contre-pulsion par ballonnet intra-aortique (CPBIA) est le dispositif de soutien le plus ancien à avoir été utilisé dans la prise en charge des patients souffrant de complications des pathologies cardiaques aiguës. La relative facilité et rapidité avec lesquelles ce dispositif peut être appliqué aux patients présentant une détérioration rapide de leur état hémodynamique ont conduit malgré le manque de preuves, à son utilisation comme intervention principale chez des patients extrêmement instables. La CPBIA est fondée sur le concept d'une contre-pulsion entraînant une décharge de pression du VG. Les principales limites de la CPBIA comprennent le manque d'assistance cardiaque active, la nécessité de la persistance d'un certain niveau de fonction du VG, la limite du soutien actif fourni et la nécessité d'une synchronisation précise avec le cycle cardiaque. Dans les essais randomisés, par rapport aux témoins, la CPBIA n'a pas eu d'effets hémodynamique ou métabolique bénéfiques supplémentaires en ce qui concerne le débit cardiaque, les résistances vasculaires systémiques, le taux de lactate artériel et les doses de catécholamines administrées. Par conséquent, chez de nombreux patients présentant une altération sévère de la fonction cardiaque et/ ou des (tachy-)arythmies persistantes, le soutien hémodynamique et la décharge du VG procurés par le traitement médical, y compris la CPBIA, peuvent s'avérer insuffisants pour maintenir la perfusion tissulaire des organes cibles. Dans ces circonstances, l'escalade vers des modalités plus avancées de MCS percutané (ou implanté) peut être justifiée. Les objectifs d'une MCS avancé comprennent l'augmentation de l'apport en O2 myocardique et l'amélioration de l'administration d'O2 aux organes cibles, prévenant ainsi le dysfonctionnement de plusieurs organes et la mort. Un débit minimal de 70 mL/kg de poids corporel par minute (représentant un indice cardiaque d'au moins 2,5 L/m2 ) est généralement nécessaire pour assurer une perfusion adéquate des organes. Ce débit est la somme du débit d'une MCS percutanée et de la fonction résiduelle de la pompe cardiaque. Il existe un certain nombre de dispositifs, dont le choix dépend de la pathologie sous-jacente, de l'expertise de l'établissement et du niveau d'assistance requis. Les principales considérations lors du choix d'une MCS portable incluent la sécurité des patients, le débit délivrable, la durabilité, la taille de l'appareil et de la canule, et la facilité de manipulation. La sécurité du patient est la préoccupation prééminente, les principales considérations étant décrites dans les sections suivantes [6] et les contre-indications potentielles énumérées dans le tableau 12.1. En outre, plusieurs autres considérations existent, applicables à tous les types de MCS.
Maladie vasculaire périphérique
Chez des patients atteints de coronaropathie, la possibilité d'une maladie artérielle périphérique doit être une préoccupation [7–9]. L'exigence d'une canulation de gros calibre via l'artère fémorale est une limitation importante de la plupart des MCS portables. Pour rendre possible l'insertion percutanée, les diamètres des canules sont généralement réduits à un maximum d'environ 10 F. Cependant, étant donné que le débit du dispositif MCS est limité par la taille de la canule artérielle, dans le choc cardiogénique, des canules de plus grandes tailles (13–17 F) sont nécessaires pour obtenir une perfusion adéquate des organes. Des stratégies visant à réduire les complications du site d'accès à l'artère fémorale, telles que l'utilisation d'une angiographie abdominale et iliofémorale pré-insertion et de l'échographie vasculaire pour guider l'accès fémoral, ont été introduites et mises en œuvre dans la pratique [10]. En cas d'urgence chez les patients atteints d'athérosclérose sévère, une angioplastie transluminale percutanée de l'artère fémorale ou un abord chirurgical direct peuvent être effectués. En fin de compte, chez les patients sous système d'assistance respiratoire extracorporelle (extracorporeal life support ou ECLS), un cathéter de perfusion distale prophylactique peut être placé en rétrograde dans l'artère fémorale superficielle [11].
Thromboembolie et saignements
La survenue d'événements thromboemboliques dépend d'un certain nombre de facteurs, notamment le type de dispositif, la durée de l'assistance, ainsi que l'emplacement et le nombre de sites de canulation [12, 13]. De nombreux facteurs physiques doivent également être pris en compte, notamment les traumatismes mécaniques, la température du sang et le flux sanguin. L'embolisation peut se produire lors de l'insertion, du fonctionnement et du retrait du dispositif [14]. Le taux d'événements thromboemboliques est relativement faible sous anticoagulation par héparine. Le traitement par héparine reste le pilier de l'anticoagulation pendant une MCS et est surveillé à l'aide du temp de coagulation activé (activated clotting time ou ACT) et/ ou du temps de prothrombine partielle activé (activated partial thromboplastin time ou aPTT) et/ou d'une héparinémie. Un ACT de 160 à 200 secondes est généralement recommandé [15]. Il n'y a pas de preuve du bénéfice d'un traitement antiplaquettaire supplémentaire dans une MCS. L'anticoagulation régionale (à l'intérieur du dispositif) peut réduire l'anticoagulation systémique et le risque de saignement, bien que l'anticoagulation systémique soit la norme.
Cardiopathie valvulaire
Les anomalies des valves cardiaques ont des conséquences importantes chez les patients candidats à une MCS, en fonction du dispositif et du site de canulation. Si l'assistance du VG consiste en une assistance oreillette gauche (OG)–aorte, une insuffisance aortique même légère à modérée peut entraîner une distension du VG en présence d'une dysfonction VG importante. Inversement, une assistance OG–aorte peut devenir la méthode de choix en cas de sténose sévère de la valve mitrale et d'altération du remplissage du VG (voir chapitre 35).
Insuffisance cardiaque droite
Une fonction cardiaque droite adéquate est nécessaire pour maintenir la précharge du VG [16]. L'insuffisance ventriculaire droite aiguë survient dans de multiples contextes, incluant l'infarctus à la phase aiguë, la myocardite fulminante, la décompensation aiguë d'insuffisance cardiaque, l'embolie pulmonaire aiguë, l'hypertension pulmonaire décompensée, la post-greffe cardiaque et le choc post-cardiotomie. Elle est un déterminant majeur de la survie [16]. Les déterminants anatomiques et physiologiques de la fonction du VD sont distincts de ceux de la fonction du VG. La gestion des défaillances du VD et du choc cardiogénique doit être adaptée en conséquence [16]. Chez les patients qui ne répondent pas aux interventions de première intention et qui développent un choc cardiogénique réfractaire secondaire à une défaillance du VD, les options d'escalade des soins sont limitées. Cependant, chez certains patients où l'on estime qu'il existe des perspectives de guérison et de survie, les dispositifs MCS temporaires peuvent constituer une option de sauvetage attrayante [16].
Dispositifs percutanés pour le support mécanique percutané à court terme
Cette section aborde les dispositifs et leurs modalités de génération d'un flux sanguin. comprendre que l'appareil ne fonctionne jamais de manière isolée est important. Comprendre l'interaction patient–circuit d'une assistance est la pierre angulaire de sa surveillance, de la gestion des défaillances et de l'évaluation des performances de l'appareil.
Contre-pulsion par ballonnet intra-aortique
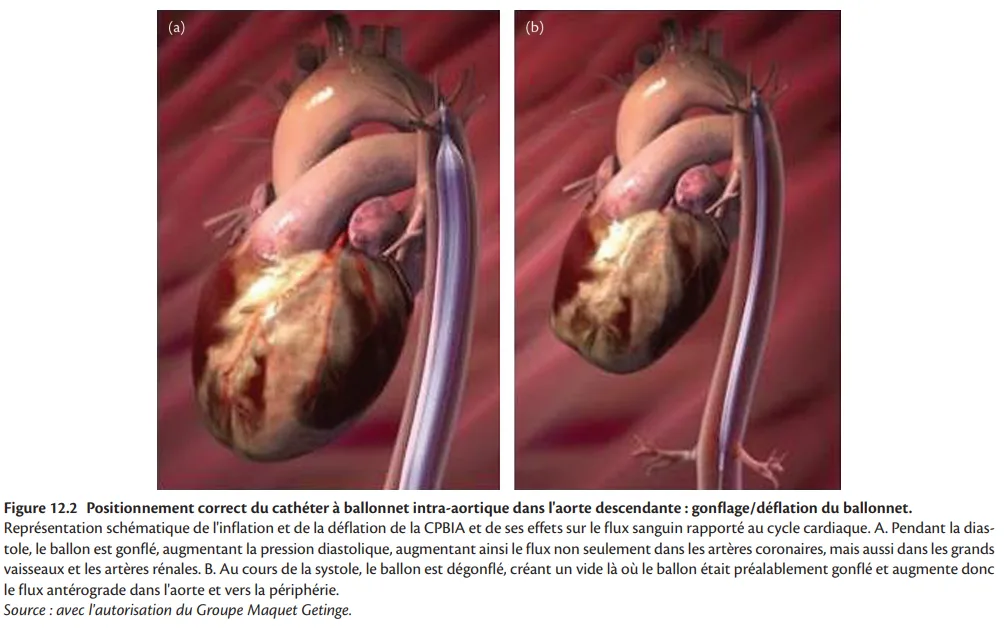
La CPBIA est actuellement l'appareil portable le plus largement utilisé pour un soutien circulatoire à court terme. Après la publication de l'essai IABP-SHOCK II (Intra-Aortic Balloon Pump in Cardiogenic Shock II) en 2012, les taux d'implantation ont diminué [17, 18]. Son action repose sur le concept de la contre-pulsion, avec l'hypothèse que la réduction de la pression en fin de diastole améliore la fonction du VG. Des études expérimentales suggèrent que la contre-pulsion améliore les performances du VG en influençant favorablement l'équilibre en O2 myocardique. Elle augmente l'apport en O2 myocardique par augmentation de la perfusion coronaire diastolique et diminue les besoins en O2 myocardique par la réduction de la post-charge et du travail cardiaque (figure 12.1). Cependant, par rapport aux témoins, il n'y a aucun effet ni sur le débit cardiaque, ni sur l'indice de puissance cardiaque, le lactate artériel ou les doses de catécholamines administrées [17, 19]. La réduction de la post-charge du VG peut théoriquement être utile chez les patients présentant une insuffisance valvulaire mitrale aiguë ou une communication interventriculaire. Les effets hémodynamiques de la CPBIA dépendent de plusieurs facteurs (encadré 12.1).

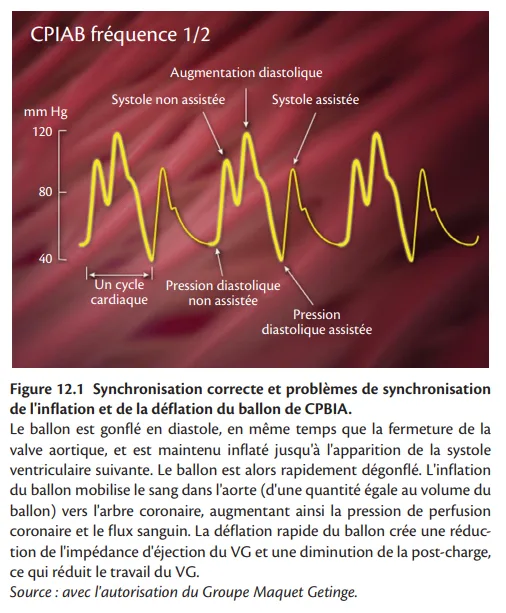
La CPBIA consiste à gonfler et à dégonfler un cathéter à ballonnet Durathane (Maquet, Fairfield, NJ, États-Unis) en synchronisation avec le cycle cardiaque du patient. Différentes tailles sont actuellement disponibles, ce qui permet d'adapter la taille du ballon à la taille du patient. Le cathéter à ballonnet est généralement inséré par une ponction fémorale jusque dans l'aorte thoracique. Le moment précis de l'inflation et de la déflation du ballon intra-aortique est crucial. Les erreurs de synchronisation produisent généralement des changements caractéristiques de la forme de l'onde de pression qui peuvent être facilement reconnus (figure 12.2). La chambre de pompe est activée par l'hélium et est généralement synchronisée avec le cœur par les signaux de l'ECG ou du transducteur de pression aortique central. La mise en œuvre de la transmission du signal de pression par fibre optique à un moniteur accélère l'acquisition du signal et le délai de traitement. Chez un patient électro-entraîné, les spikes du stimulateur cardiaque peuvent être utilisés pour détecter les événements du cycle cardiaque. Un mode de déclenchement interne est disponible pour les patients en asystolie. La tachycardie extrême et les arythmies cardiaques peuvent affecter l'efficacité de la CPBIA. Le déclenchement par l'onde de pression n'est pas recommandé chez les patients atteints de fibrillation atriale (FA). Les contre-indications absolues de la CPBIA comprennent l'insuffisance valvulaire aortique sévère et une dissection aortique (aiguë). Un anévrisme de l'aorte, une maladie vasculaire iliofémorale sévère et des antécédents de chirurgie aortique sont des contre-indications relatives. Les complications associées à la CPBIA sont moins fréquentes à l'ère moderne. L'essai IABP-SHOCK n'a pas observé un taux plus élevé de complications potentiellement liées au dispositif chez les patients traités par CPBIA par rapport au groupe témoin.
Les indications et les applications de la CPBIA ont parcouru un long chemin depuis ses premiers jours. La CPBIA n'améliore pas les résultats cliniques chez les patients atteints d'infarctus aigu et de choc cardiogénique sans complications mécaniques, ni ne limite significativement la taille de l'infarctus chez ceux présentant des infarctus antérieurs potentiellement importants [17, 19–21]. Par conséquent, les recommandations de l'European Society of Cardiology (ESC) ne préconisent pas l'utilisation systématique de la CPBIA chez les patients atteints d'infarctus du myocarde aigu et de choc cardiogénique [22, 23]. Cependant, la contre-pulsation peut être utilisée sur la base d'un consensus d'experts, en l'absence de données sur des résultats cliniques, chez certains patients présentant une instabilité hémodynamique ou un choc cardiogénique dus à des complications mécaniques (c'est-à-dire une insuffisance mitrale sévère ou une communication interventriculaire) [22]. Il convient également de noter que l'utilisation systématique de la CPBIA avant l'angioplastie à haut risque n'a pas réduit le critère d'évaluation principal, c'est-à-dire les événements cardiaques et cérébrovasculaires majeurs (major adverse cardiac and cerebrovascular event ou MACCE), un composite de décès, d'infarctus aigu du myocarde, d'événement cérébrovasculaire ou de revascularisation supplémentaire, à la sortie de l'hôpital (suivi à 28 jours) [24]. La CPBIA est un exemple typique d'un traitement fondé sur un concept qui, par la suite, dans les essais, n'a pas prouvé qu'il changeait le devenir des patients.
Support circulatoire mécanique avancé
Bien que chaque appareil ait ses propres caractéristiques, les MCS avancés de court terme disponibles peuvent être classés en deux types : les pompes à flux axial et les pompes centrifuges. Un nouveau système de soutien circulatoire pulsatile avec une pompe à membrane extracorporelle a récemment été introduit en tant que troisième type. Aujourd'hui, il n'existe pas d'études comparatives analysant les avantages potentiels d'un système MCS par rapport à un autre. De plus, les essais randomisés publiés n'ont pas démontré de bénéfice en faveur d'une MCS avancée par rapport à la CPBIA dans les syndromes d'insuffisance cardiaque aiguë et le choc cardiogénique [25–28].
Pompes à débit axial intracardiaque : la plateforme Impella®/le HeartMate®
Impella®
L'Impella® (Abiomed, Danvers, MA, États-Unis) est une pompe microaxiale intravasculaire montée sur un cathéter, entraînée par un moteur électrique externe pour une utilisation à court terme (Impella® 5.5 validée jusqu'à 30 jours en Europe). Le cathéter Impella® délivre le sang de la zone d'entrée, qui se trouve à l'intérieur du VG, à travers la canule, jusqu'à l'ouverture de sortie dans l'aorte ascendante. L'appareil présente un cathéter en queue de cochon à son extrémité pour assurer une position stable dans le VG et empêcher l'adhérence au myocarde. Les systèmes de pompe à débit axial permettent une décharge du VG et une réduction de la contrainte transmurale du VG [28]. L'Impella Left® est disponible en quatre versions. Les cathéters Impella® 2.5 (12 F), Impella® 5.0 (21 F), Impella® 5.5 et Impella® CP (14 F) peuvent être insérés par voie percutanée à travers l'artère fémorale (Impella® 5.0 par une artériotomie chirurgicale fémorale uniquement) ou axillaire jusqu'au VG. L'Impella® LD est inséré directement à travers l'aorte ascendante et dans le VG. Les cathéters Impella® 5.0 et Impella® LD ont un capteur de pression différentielle électronique situé à l'extrémité proximale de la canule 21 F qui génère le signal de placement, lequel est utilisé par les opérateurs et le contrôleur pour surveiller la position de la canule Impella® par rapport à la valve aortique. Comme pour toutes les pompes axiales, ses performances dépendent de la vitesse rotative (tableau) et du différentiel de pression aorte–VG (pression aortique moins pression VG) surveillé en permanence. Bien que la vitesse de rotation soit maintenue constante (selon la sélection de l'utilisateur), la variation du différentiel de pression pendant le cycle cardiaque entraîne généralement un schéma d'écoulement pulsatile. Il reste à déterminer si le soutien mécanique supplémentaire fourni par la plus petite Impella® 2.5 ou l'Impella CP® sera suffisant pour les patients présentant un collapsus circulatoire [29–35]. Plus prometteurs à cet égard sont l'Impella® 5.0/LD et l'Impella® 5.5, cette dernière étant capable de délivrer un débit continu allant jusqu'à 6,0 L/min [36–38]. Dans un modèle d'infarctus chez le mouton, il a été démontré que l'Impella® 5.0 réduisait la demande d'O2 myocardique et la taille de l'infarctus [5]. L'Impella® 5.0 est implanté le plus souvent via l'artère sous-clavière, ce qui permet la déambulation du patient, bien qu'une minorité d'implants soient réalisés par voie fémorale [36]. Les limites des dispositifs de support axial sont liées à leur position à travers la valve aortique dans le VG. L'Impella® est contre-indiqué chez les patients présentant un thrombus mural dans le VG, une valve aortique mécanique, une sténose/calcification de la valve aortique (équivalente à une surface ≤ 0,6 cm2 ), une insuffisance aortique modérée à sévère (évaluation échocardiographique classée ≥ 2+) ou une tamponnade cardiaque. En raison de la vitesse de rotation élevée de l'Impella®, elle peut également provoquer une hémolyse importante principalement liée à une position suboptimale ou instable de l'orifice d'entrée dans le VG ou trop près de la valve aortique [39].
HeartMate® PHP
Le HeartMate® PHP (percutaneous heart pump ou pompe cardiaque percutanée) est également une pompe à débit axial sur un cathéter. Le cathéter de pompe en élastomère souple est inséré à travers une gaine de 14 F, déployé à travers la valve aortique, s'expandant jusqu'à 24 F et capable de fournir jusqu'à 5 L/min de débit sanguin à des vitesses de fonctionnement modestes [40]. Cette caractéristique de conception unique fait de cet appareil la canule d'insertion de plus bas profil avec le débit le plus élevé. Pour son retrait, le système peut être réduit à sa taille initiale de 13 F. L'expérience clinique avec le dispositif est limitée à l'angioplastie à haut risque [41]. Le développement clinique du HeartMate® PHP a en fait été suspendu en raison d'un petit nombre d'événements cliniques liés à un arrêt inapproprié de la pompe dans l'essai clinique Shield II et dans le cadre d'utilisations commerciales.
Pompes centrifuges
Les pompes centrifuges fonctionnent d'une manière similaire à celle de certaines pompes de circulation extracorporelle (CEC) [42]. Elles sont généralement constituées d'un rotor en forme de cône contenu dans un boîtier en plastique ou en métal. Le sang s'écoule dans la pompe au sommet du cône et sort au bord de la base. La rotation du rotor crée une force centrifuge qui est transmise au sang, générant un flux continu et non pulsatile. L'accès artériel fémoral est assuré par des canules artérielles de gros calibre (allant de 16 F à 19 F) et veineuses (17–21 F). La canulation fémorale bilatérale à l'aide d'une canule de plus petite taille peut être une option chez les petits patients. L'ischémie des membres causée par la canulation fémorale peut être évitée par perfusion distale de la jambe avec un petit cathéter (5 F) placé dans l'artère distale.
Extracorporeal membrane oxygenation (ECMO)/ extracorporeal cardiac life support (ECLS)
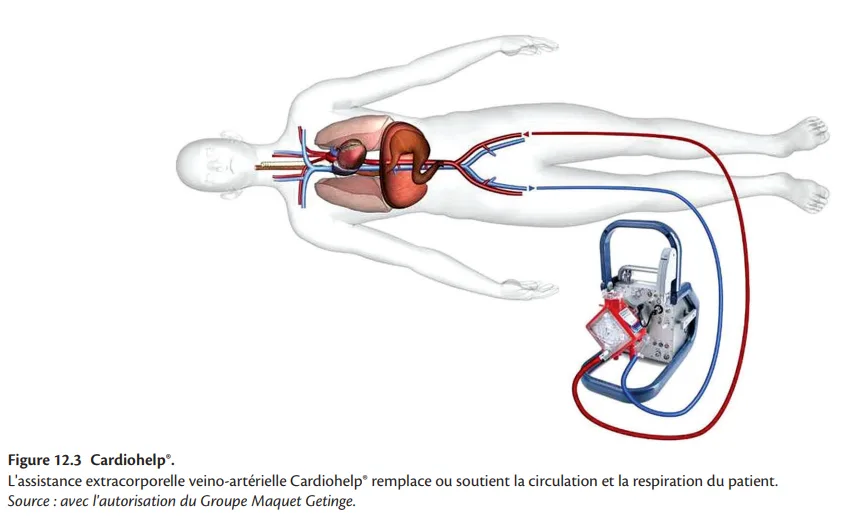
L'ECMO intègre une pompe centrifuge et un oxygénateur extracorporel. La technique percutanée pour la mise en place d'une CEC d'assistance fémoro-fémorale (percutaneous cardiopulmonary bypass support ou PCBS), utilisant le système portable développé par Bard, a été décrite dès 1990 [43]. Le sang est aspiré par une pompe centrifuge depuis l'oreillette droite à travers une longue canule de dérivation de 17 à 21 F insérée dans la veine fémorale et est renvoyé au moyen d'un oxygénateur à membrane avec échangeur de chaleur vers une canule artérielle fémorale (16–19 F); des débits allant jusqu'à 6 L/min peuvent être obtenus, fournissant un soutien respiratoire et circulatoire presque complet, indépendamment du rythme cardiaque intrinsèque ou de la fonction ventriculaire. La pompe fournit un débit continu avec le maintien d'une pression artérielle pulsatile, à moins que la circulation ne soit complètement prise en charge par le dispositif d'assistance. L'ECMO peut être configurée en fonction des besoins du patient : ECMO veino-veineuse pour l'assistance respiratoire isolée, et ECMO veino-artérielle pour le soutien respiratoire et hémodynamique (en cas de défaillance du VD, du VG ou biventriculaire) [44–46]. Bien que l'ECMO veino-artérielle puisse soutenir à la fois la respiration et la circulation, le fonctionnement optimal du système dépend de la précharge et peut être entravé en cas d'hypovolémie (par exemple, saignements graves) ou de tamponnade. Les complications fréquentes comprennent l'ischémie des membres inférieurs (16,9 %), les accidents vasculaires cérébraux (5,9 %), les saignements majeurs (40,8 %) et les infections importantes (30,4 %) [13, 14, 47]. L'augmentation de la post-charge avec l'ECMO veino-artériel peut provoquer une distension du VG – en particulier lorsque l'éjection du VG est sévèrement diminuée ou en cas d'insuffisance valvulaire aortique – et peut encore augmenter les pressions du VG et de l'OG [47, 48]. L'incapacité à décharger le cœur gauche peut entraîner un œdème pulmonaire et une hypoxémie du haut du corps, c'est-à-dire une ischémie myocardique et cérébrale [48]. Dans ces circonstances, une décharge du VG non chirurgicale peut être obtenue par septostomie atriale, par un cathéter en queue de cochon 7 F dans le VG connecté au côté veineux de l'ECMO, ou par l'insertion d'un dispositif supplémentaire offrant des propriétés de décharge du VG (Impella® ou CPBIA) [49–54]. Encore une fois, les avantages et les risques des systèmes de décharge du VG n'ont pas été étudiés de manière approfondie et ne sont que théoriques. L'expérience initiale avec l'ECMO a été entravée par la relative complexité du système, nécessitant une équipe spécialisée, y compris des perfusionnistes; une morbidité élevée due à un taux élevé de complications associées; la nécessité d'une circulation extracorporelle et d'un oxygénateur à membrane, avec activation des éléments cellulaires; et une durée d'assistance limitée (habituellement < 6 heures) en raison de complications hématologiques et pulmonaires graves. Une utilisation prolongée jusqu'à plusieurs semaines a été rendue possible grâce à l'intégration d'un circuit à revêtement interne et d'oxygénateurs biocompatibles, intégrant une technologie de fibre imperméable au plasma, conçus pour une perfusion prolongée. La mise en place percutanée rapide d'une ECMO reste la technique la plus puissante d'assistance hémodynamique chez des patients souffrant de choc cardiogénique, d'arrêt cardiaque, et de complications d'une angioplastie coronaire [2, 3]. L'impact clinique des appareils portables plus récents et moins complexes, tels que le système Cardiohelp® (Maquet Cardiopulmonary AG, Hirrlingen, Allemagne) (figure 12.3), doit encore être évalué dans de futurs essais.
Dispositif d'assistance ventriculaire gauche percutané de l'atrium gauche à l'artère fémorale (à court terme, centrifuge) : TandemHeart™
Contrairement à l'ECMO, les assistances cardiaques gauches à thorax clos gardent les poumons du patient comme seul site d'échange gazeux et d'hématose. Le TandemHeart™ (Tandemlife, Pittsburg, PA, États-Unis) intègre une pompe centrifuge à flux continu à basse vitesse avec une faible surface de contact avec le sang, ce qui réduit le risque d'hémolyse et de thromboembolies. Le sang oxygéné de l'OG du patient est acheminé vers la pompe via une canule trans-septale de 21 F introduite depuis l'OD, puis renvoyé à la circulation systémique du patient via une canule artérielle via l'artère fémorale (12– 19 F chez la plupart des patients) jusqu'à l'aorte abdominale inférieure (figure 12.4). La réussite de mise en place de ce dispositif nécessite une équipe d'opérateurs formés, y compris un opérateur familier avec la ponction trans-septale [55]. Le système peut délivrer jusqu'à 4,0 L de débit sanguin par minute, en fonction de la taille de la canule artérielle et des conditions de remplissage de l'OG, tout en fonctionnant à une vitesse relativement faible (7500 tr/min). Comme pour tout dispositif d'assistance gauche, la précharge de la pompe, et donc le débit, dépend d'une fonction cardiaque droite adéquate.
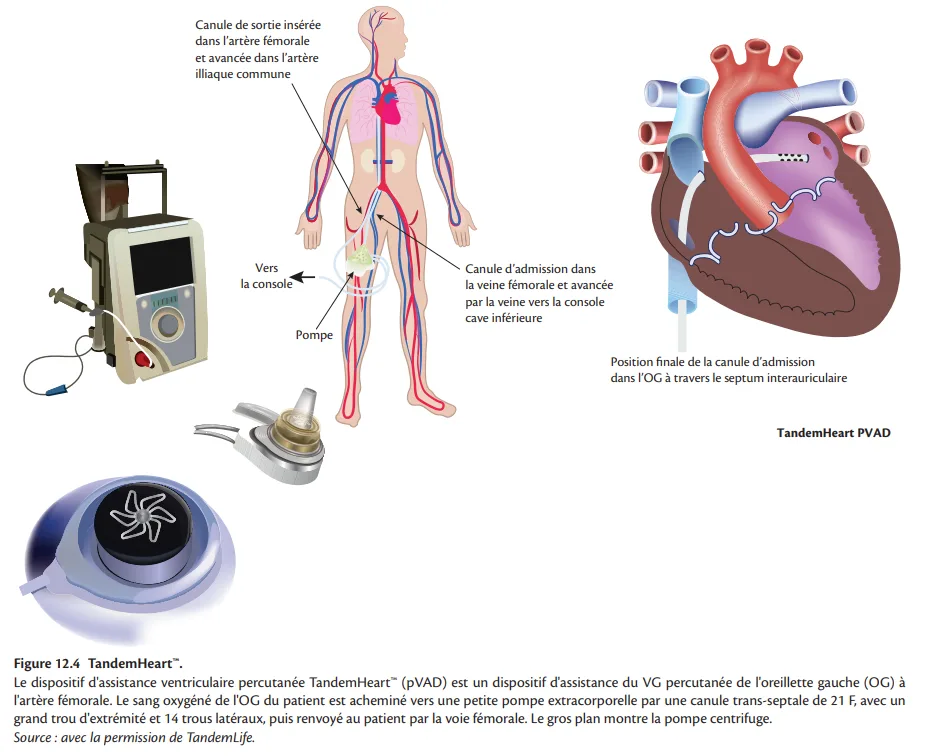
Il existe de plus en plus de preuves que ce dispositif peut être suffisant pour prévenir, ou même inverser, le dysfonctionnement des organes chez les patients atteints de choc cardiogénique. Cependant, dans deux essais randomisés, il n'y avait pas de réduction de la mortalité [56, 57]. Une étude récente en monocentrique sur le traitement «avancé» avec le TandemHeart™ chez des patients atteints de choc cardiogénique réfractaire sévère malgré le traitement standard, y compris la CPBIA, a montré un taux de mortalité remarquable à 6 mois de 45,3 % [58]. Les taux de complications sont semblables à ceux des autres systèmes d'assistance [57].
PulseCath iVAC 2L®
Le PulseCath iVAC 2L® (PulseCath BV, Amsterdam, Pays-Bas) est un système de support pulsatile de nouvelle génération piloté par n'importe quelle console de CPBIA standard et générant un flux sanguin pulsatile allant jusqu'à 2 L/min, en fonction des conditions de précharge et de postcharge et de la fréquence cardiaque [59]. Une pompe à membrane extracorporelle est connectée à un cathéter 17 F (gaine d'accès 19 F), qui est inséré par voie retrograde à travers la valve aortique dans le VG.µ Dans la phase systolique du cycle cardiaque, du sang du VG est aspiré à travers la lumière du cathéter dans la pompe à membrane. Pendant la phase diastolique, la pompe renvoie le sang à travers le cathéter, ouvrant ensuite la valve du cathéter et acheminant le sang vers l'aorte ascendante par l'orifice d'écoulement latéral. Les données sont limitées à de petites séries de cas, et l'impact clinique de ce dispositif nécessite une enquête plus approfondie [41].
Support ventriculaire droit
Plusieurs approches pour le soutien en VD ont été décrites.
Impella® RP
Le système Impella® RP (≥ 4,0 L/min) est indiqué pour fournir une assistance temporaire du VD jusqu'à 14 jours chez les patients qui développent une insuffisance cardiaque droite aiguë. L'Impella® RP (canule 11 F, moteur de pompe 22 F) peut être insérée par une procédure de cathétérisme standard via la veine fémorale, dans l'OD, à travers les valves tricuspide et pulmonaire, et dans l'artère pulmonaire. Les données sont limitées à de petites séries de cas, et l'impact clinique de ce dispositif nécessite une enquête plus approfondie [30, 59, 60].
Pompes centrifuges
Cette stratégie utilise une pompe centrifuge extracorporelle avec un flux entrant par une canule atriale droite et sortant dans l'artère pulmonaire. Plusieurs pompes à débit centrifuges différentes ont été utilisées avec cette stratégie de canulation. Deux canules sont utilisées – généralement deux canules veineuses fémorales ou une canule veineuse fémorale et une canule veineuse jugulaire interne – avec une canule positionnée dans l'OD et une autre dans l'artère pulmonaire. Comme alternative, une nouvelle canule coaxiale à double lumière suffisamment flexible pour être positionnée avec son extrémité distale dans l'artère pulmonaire à partir d'une insertion jugulaire interne peut être utilisée avec une pompe à débit centrifuge pour obtenir un dispositif d'assistance du VD percutané [60]. En raison de son site de canulation jugulaire interne, cette configuration permet la déambulation pendant la période d'assistance. Le retrait se fait généralement par une suture en cordon de bourse au chevet du patient.
Conclusion
La mise en œuvre de systèmes MCS avancés percutanés est très prometteuse. Pourtant, le manque de preuves à l'appui de l'utilisation de ces dispositifs est notable. Les dispositifs disponibles diffèrent en termes de procédure d'insertion, de propriétés mécaniques et de mode d'action. Il reste à étudier si cette hétérogénéité se traduit par une différence hémodynamique et clinique significative. Dans tous les cas, les clés du succès sont la sélection appropriée des patients et les soins dans des centres d'excellence cardiothoraciques.
Urgences et Soins Intensifs de Cardiologie S’ouvre dans une nouvelle fenêtre © 2023, Elsevier Masson SAS. Tous droits réservés
Les auteurs de ce chapitre
H. Thiele, Heart Center Leipzig at University of Leipzig, Department of Internal Medicine/ Cardiology, Leipzig, Allemagne. P. Vranckx, Cardiac ITU, Virga Jesse Ziekenhuis, Hasselt, Belgique.
À lire aussi
Veines superficielles et profondes des membres S’ouvre dans une nouvelle fenêtre. Traitements endoveineux et chirurgicaux, par Y. Alimi, O. Hartung, V. Crébasse. 2023, 392 pages. Imagerie cardiaque S’ouvre dans une nouvelle fenêtre, par J.P. Laissy, A. Fuerber. 2021, 432 pages Thromboses veineuses distales et superficielles S’ouvre dans une nouvelle fenêtre, F. Minvielle, S. Le Jeune. 2021, 256 pages Télésoin et télémédecine S’ouvre dans une nouvelle fenêtre, par P. Simon et T. Moulin. 2021, 192 pages.
Références 1. Kapur NK, Qiao X, Paruchuri V, et al. Mechanical pre-conditioning with acute circulatory support before reperfusion limits infarct size in acute myocardial infarction. JACC Heart Fail 2015 ;3:873–82. 2. Kim SJ, Kim HJ, Lee HY, Ahn HS, Lee SW. Comparing extracorporeal cardiopulmonary resuscitation with conventional cardiopulmonary resuscitation: a meta-analysis. Resuscitation 2016 ;103:106–16. 3. Pineton de Chambrun M, Brechot N, Lebreton G, et al. Venoarterial extracorporeal membrane oxygenation for refractory cardiogenic shock post-cardiac arrest. Intensive Care Med 2016 ;42:1999–2007. 4. Myat A, Patel N, Tehrani S, Banning AP, Redwood SR, Bhatt DL. Percutaneous circulatory assist devices for high-risk coronary intervention. JACC Cardiovasc Interv 2015 ;8:229–44. 5. Meyns B, Dens J, Sergeant P, Herijgers P, Daenen W, Flameng W. Initial experiences with the Impella device in patients with cardiogenic shock—Impella support for cardiogenic shock. Thorac Cardiovasc Surg 2003 ;51:312–7. 6. Cohen M, Urban P, Christenson JT, et al. Intra-aortic balloon counterpulsation in US and non-US centres: results of the Benchmark Registry. Eur Heart J 2003 ;24:1763–70. 7. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee Lancet 1996 ;348:1329–39. 8. Dormandy JA, Rutherford RB. Management of peripheral arterial disease (PAD). TASC Working Group. TransAtlantic Inter-Society Consensus (TASC). J Vasc Surg 2000 ;31(1 Pt 2):S1–296. 9. Patel MR, Conte MS, Cutlip DE, et al. Evaluation and treatment of patients with lower extremity peripheral artery disease: consensus definitions from Peripheral Academic Research Consortium (PARC). J Am Coll Cardiol 2015 ;65:931–41. 10. Vranckx P, Schultz CJ, Valgimigli M, et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheter Cardiovasc Interv 2009 ;74:302–10. 11. Lamb KM, DiMuzio PJ, Johnson A, et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. J Vasc Surg 2017 ;65:1074–9. 12. Dalton HJ, Reeder R, Garcia-Filion P, et al. Factors associated with bleeding and thrombosis in children receiving extracorporeal membrane oxygenation. Am J Respir Crit Care Med 2017 ;196:762–71. 13. Murphy DA, Hockings LE, Andrews RK, et al. Extracorporeal membrane oxygenation-hemostatic complications. Transfus Med Rev 2015 ;29:90–101. 14. Thomas J, Kostousov V, Teruya J. Bleeding and thrombotic complications in the use of extracorporeal membrane oxygenation. Semin Thromb Hemost 2018 ;44:20–9. 15. Sy E, Sklar MC, Lequier L, Fan E, Kanji HD. Anticoagulation practices and the prevalence of major bleeding, thromboembolic events, and mortality in venoarterial extracorporeal membrane oxygenation: a systematic review and meta-analysis. J Crit Care 2017 ;39:87–96. 16. Kapur NK, Paruchuri V, Jagannathan A, et al. Mechanical circulatory support for right ventricular failure. JACC Heart Fail 2013 ;1:127–34. 17. Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012 ;367:1287–96. 18. Sandhu A, McCoy LA, Negi SI, et al. Use of mechanical circulatory support in patients undergoing percutaneous coronary intervention: insights from the National Cardiovascular Data Registry. Circulation 2015 ;132:1243–51. 19. Prondzinsky R, Unverzagt S, Russ M, et al. Hemodynamic effects of intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic shock: the prospective, randomized IABP shock trial. Shock 2012 ;37:378–84. 20. Patel MR, Smalling RW, Thiele H, et al. Intra-aortic balloon counterpulsation and infarct size in patients with acute anterior myocardial infarction without shock: the CRISP AMI randomized trial. JAMA 2011 ;306:1329–37. 21. Thiele H, Zeymer U, Neumann FJ, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet 2013 ;382:1638–45. 22. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018 ;39:119–77. 23. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019 ;40:87–165. 24. Perera D, Stables R, Clayton T, et al. Long-term mortality data from the balloon pump-assisted coronary intervention study (BCIS-1): a randomized, controlled trial of elective balloon counterpulsation during high-risk percutaneous coronary intervention. Circulation 2013 ;127:207–12. 25. Rios SA, Bravo CA, Weinreich M, et al. Meta-analysis and trial sequential analysis comparing percutaneous ventricular assist devices versus intra-aortic balloon pump during high-risk percutaneous coronary intervention or cardiogenic shock. Am J Cardiol 2018 ;122:1330–8. 26. Cheng JM, den Uil CA, Hoeks SE, et al. Percutaneous left ventricular assist devices vs. intra-aortic balloon pump counterpulsation for treatment of cardiogenic shock: a meta-analysis of controlled trials. Eur Heart J 2009 ;30:2102–8. 27. Thiele H, Jobs A, Ouweneel DM, et al. Percutaneous short-term active mechanical support devices in cardiogenic shock: a systematic review and collaborative meta-analysis of randomized trials. Eur Heart J 2017 ;38:3523–31. 28. Ouweneel DM, Eriksen E, Sjauw KD, et al. Percutaneous mechanical circulatory support versus intra-aortic balloon pump in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2017 ;69:278–87. 29. Burzotta F, Trani C, Doshi SN, et al. Impella ventricular support in clinical practice: collaborative viewpoint from a European expert user group. Int J Cardiol 2015 ;201:684–91. 30. Jensen PB, Kann SH, Veien KT, et al. Single-centre experience with the Impella CP, 5.0 and RP in 109 consecutive patients with profound cardiogenic shock. Eur Heart J Acute Cardiovasc Care 2018 ;7:53–61. 31. Kapur NK, Alkhouli M, DeMartini T, et al. Unloading the left ventricle before reperfusion in patients with anterior ST-segment elevation myocardial infarction: a pilot study using the Impella CP((R)). Circulation 2019 ;139:337–46. 32. Lauten A, Engstrom AE, Jung C, et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Fail 2013 ;6:23–30. 33. O'Neill WW, Kleiman NS, Moses J, et al. A prospective, randomized clinical trial of hemodynamic support with Impella 2.5 versus intra-aortic balloon pump in patients undergoing high-risk percutaneous coronary intervention: the PROTECT II study. Circulation 2012 ;126:1717–27. 34. Ouweneel DM, de Brabander J, Karami M, et al. Real-life use of left ventricular circulatory support with Impella in cardiogenic shock after acute myocardial infarction: 12 years AMC experience. Eur Heart Acute Cardiovasc Care 2019 ;8:338–49. 35. Vetrovec GW, Anderson M, Schreiber T, et al. The cVAD registry for percutaneous temporary hemodynamic support: a prospective registry of Impella mechanical circulatory support use in high-risk PCI, cardiogenic shock, and decompensated heart failure. Am Heart J 2018 ;199:115–21. 36. Boll G, Fischer A, Kapur NK, Salehi P. Right axillary artery conduit is a safe and reliable access for implantation of Impella 5.0 microaxial pump. Ann Vasc Surg 2019 ;54:54–9. 37. Esposito ML, Jablonski J, Kras A, Krasney S, Kapur NK. Maximum level of mobility with axillary deployment of the Impella 5.0 is associated with improved survival. Int J Artif Organs 2018 ;41:236–9. 38. Schibilsky D, Lausberg H, Haller C, et al. Impella 5.0 Support in INTERMACS II cardiogenic shock patients using right and left axillary artery access. Artif Organs 2015 ;39:660–3. 39. Sibbald M, Dzavik V. Severe hemolysis associated with use of the Impella LP 2.5 mechanical assist device. Catheter Cardiovasc Interv 2012 ;80:840–4. 40. Van Mieghem NM, Daemen J, den Uil C, et al. Design and principle of operation of the HeartMate PHP (percutaneous heart pump). EuroIntervention 2018 ;13:1662–6. 41. den Uil CA, Daemen J, Lenzen MJ, et al. Pulsatile iVAC 2L circulatory support in high-risk percutaneous coronary intervention. EuroIntervention 2017 ;12:1689–96. 42. Edmunds LH. Cardiopulmonary bypass after 50 years. N Engl J Med 2004 ;351:1603–6. 43. Vogel RA, Shawl F, Tommaso C, et al. Initial report of the National Registry of Elective Cardiopulmonary Bypass Supported Coronary Angioplasty. J Am Coll Cardiol 1990 ;15:23–9. 44. Bein T, Aubron C, Papazian L. Focus on ECMO and ECCO2R in ARDS patients. Intensive Care Med 2017 ;43:1424–6. 45. Brodie D, Bacchetta M. Extracorporeal membrane oxygenation for ARDS in adults. N Engl J Med 2011 ;365:1905–14. 46. Guglin M, Zucker MJ, Bazan VM, et al. Venoarterial ECMO for adults: IACC Scientific Expert Panel. J Am Coll Cardiol 2019 ;73:698–716. 47. Burkhoff D, Sayer G, Doshi D, Uriel N. Hemodynamics of mechanical circulatory support. J Am Coll Cardiol 2015 ;66:2663–74. 48. Prasad A, Ghodsizad A, Brehm C, et al. Refractory pulmonary edema and upper body hypoxemia during veno-arterial extracorporeal membrane oxygenation: a case for atrial septostomy. Artif Organs 2018 ;42:664–9. 49. Pappalardo F, Schulte C, Pieri M, et al. Concomitant implantation of Impella® on top of veno-arterial extracorporeal membrane oxygenation may improve survival of patients with cardiogenic shock. Eur J Heart Fail 2017 ;19:404–12. 50. Rupprecht L, Florchinger B, Schopka S, et al. Cardiac decompression on extracorporeal life support: a review and discussion of the literature. ASAIO J 2013 ;59:547–53. 51. Tepper S, Garcia MB, Fischer I, et al. Clinical outcomes and reduced pulmonary artery pressure with intra-aortic balloon pump during central extracorporeal life support. ASAIO J 2019 ;65:173–9. 52. Vallabhajosyula S, O'Horo JC, Antharam P, et al. Concomitant intra-aortic balloon pump use in cardiogenic shock requiring venoarterial extracorporeal membrane oxygenation. Circulation Cardiovasc Interv 2018 ;11, e006930. 53. Barbone A, Malvindi PG, Ferrara P, Tarelli G. Left ventricle unloading by percutaneous pigtail during extracorporeal membrane oxygenation. Interactive Cardiovasc Thorac Surg 2011 ;13:293–5. 54. Russo JJ, Aleksova N, Pitcher I, et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. J Am Coll Cardiol 2019 ;73:654–62. 55. Inoue K, Owaki T, Nakamura T, Kitamura F, Miyamoto N. Clinical application of transvenous mitral commissurotomy by a new balloon catheter. J Thorac Cardiovasc Surg 1984 ;87:394–402. 56. Burkhoff D, Cohen H, Brunckhorst C, O'Neill WW. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J 2006 ;152(469):e1–8. 57. Thiele H, Sick P, Boudriot E, et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005 ;26:1276–83. 58. Kar B, Gregoric ID, Basra SS, Idelchik GM, Loyalka P. The percutaneous ventricular assist device in severe refractory cardiogenic shock. J Am Coll Cardiol 2011 ;57:688–96. 59. Van Mieghem NM, Daemen J, Lenzen MJ, Zandstra R, Malkin O, van Geuns RJ. The PulseCath iVAC 2L left ventricular assist device: conversion to a percutaneous transfemoral approach. EuroIntervention 2015 ;11:835–9. 60. Aggarwal V, Einhorn BN, Cohen HA. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovasc Interv 2016 ;88:390–6.