Discordance entre HbA1c et résultat de l’autosurveillance glycémique
7 mars 2017
Par Anne Claire Nonnotte
Nous vous invitons à découvrir le chapitre 6 de l’ouvrage Diabétologie: 55 démarches cliniques en pratique médicale courante S’ouvre dans une nouvelle fenêtre
Introduction aux cas cliniques, état de l’art
Depuis la mise au point de son dosage, dans les années 1970–1980 [1–3], l’HbA1c est considérée comme le « gold standard » de la surveillance des états diabétiques [4–6]. Ce dosage paraît aujourd’hui d’une telle banalité que l’on finit par oublier toutes les étapes qui ont mené à l’obtention d’un dosage fiable. Le succès de l’HbA1c en tant que marqueur de l’équilibre glycémique est lié à deux éléments : il intègre l’exposition totale au glucose sur une période de 3 mois [4,7–9] et son dosage trimestriel est indépendant de l’heure du prélèvement, puisque le taux de l’HbA1c n’est pas influencé par la proximité d’une prise alimentaire. Chez l’adulte normal, la majorité de l’hémoglobine (Hb) dans les globules rouges natifs est représentée par l’HbA (97 % du total), le reste étant sous forme d’HbA2 (2,5 % du total) et d’HbF (0,5 % du total).
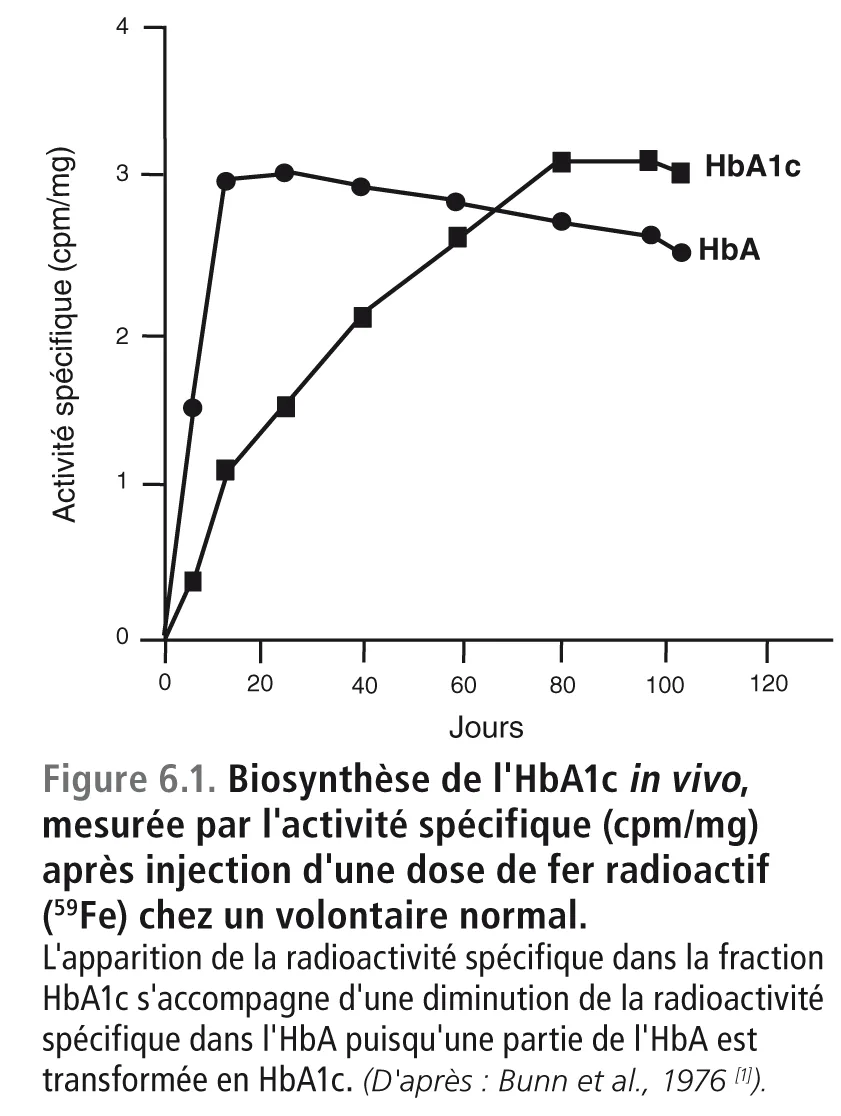
Ces trois types d’hémoglobine sont codés par des gènes différents. Leurs différences résident dans les quatre chaînes protéiques qui s’insèrent sur les quatre noyaux héminiques centraux : deux chaînes α et deux chaînes β pour l’HbA ; deux chaînes α et deux chaînes δ pour l’HbA2 ; deux chaînes α et deux chaînes γ pour l’HbF. À ces variantes génétiques viennent se surajouter des modifications post-traductionnelles qui portent sur l’HbA et qui sont obtenues par carbamylation, acylation, sulfatation et surtout par glycation. Cette dernière réaction conduit à la fixation non enzymatique d’un sucre ou d’un dérivé sucré sur une chaîne protéique. Dans le cas de l’HbA1c, cette réaction post-traductionnelle démarre avec la naissance du globule rouge, à l’instant où il se trouve pour la première fois de son existence au contact du glucose plasmatique [1,7]. Elle se poursuit ultérieurement pendant les 120 jours de la durée de vie du globule rouge (figure 6.1). La fixation non enzymatique (« glycation ») est proportionnelle à la concentration plasmatique du glucose[1,7].
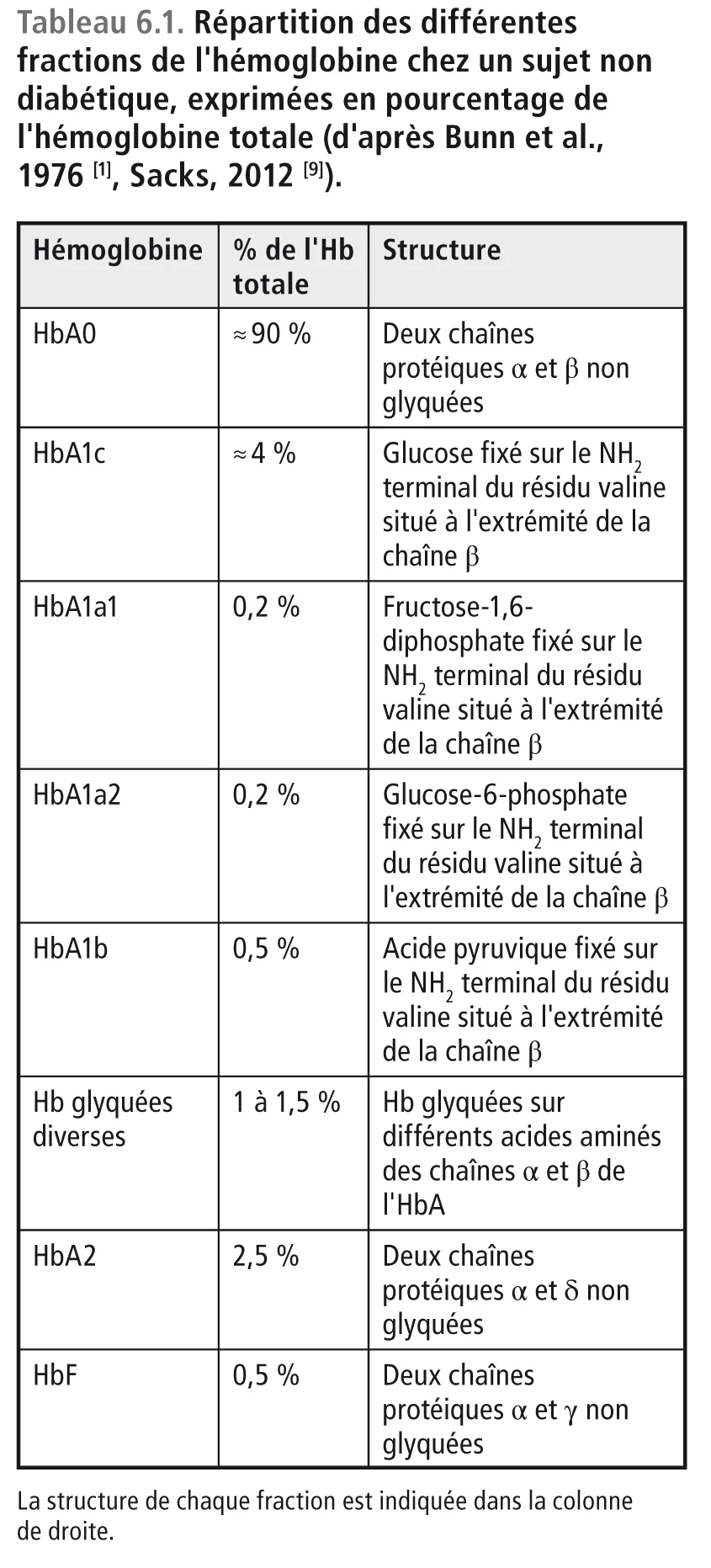
Ainsi une partie de l’HbA, qui constitue 97 % de l’hémoglobine totale dans le globule rouge natif, se transforme en hémoglobine glyquée. Dans le sang d’un adulte normal, qui est constitué par une cohorte d’érythrocytes jeunes, vieux ou d’âge intermédiaire, les différentes fractions de l’Hb sont réparties de la manière suivante (tableau 6.1).
HbA0, ou Hb non glyquée
Elle est constituée de deux chaînes protéiques α et β avec un résidu aminé sous forme de valine en N-terminal de la chaîne β.
HbA1c (vraie)
Elle est constituée des mêmes chaînes protéiques α et β que l’HbA0, mais une molécule de glucose est attachée à la valine située en N-terminal de la chaîne β. C’est cette variété d’hémoglobine qui constitue l’HbA1c proprement dite. HbA1a1, HbA1a2, HbA1b Les hémoglobines A1a1, A1a2 et A1b sont constituées par les mêmes chaînes que l’HbA0 mais sur la valine située en N-terminal de la chaîne β se sont fixés respectivement soit du fructose-1,6-diphosphate (HbA1a1), soit du glucose-6-phosphate (HbA1a2), soit de l’acide pyruvique (HbA1b). Ces hémoglobines sont des composantes mineures qui peuvent être séparées de l’HbA1c par chromatographie liquide de haute performance (HPLC). Ceci signifie que les pics qui correspondent à ces trois hémoglobines mineures n’interfèrent pas sur le dosage de l’HbA1c.
Hémoglobines glyquées diverses autres que l’HbA1c
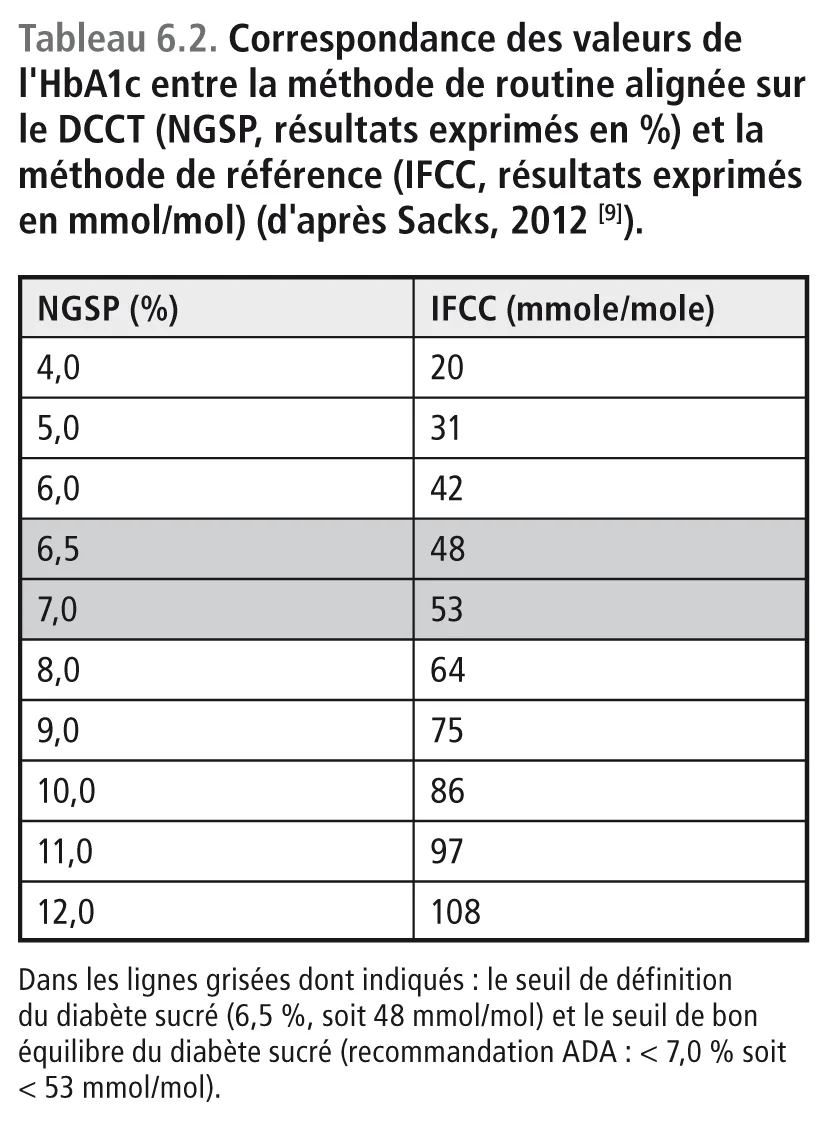
Ce sont des hémoglobines qui ont fixé du glucose sur d’autres acides aminés que la valine, en particulier sur la lysine qui est présente de manière dispersée le long des chaînes protéiques α et β de l’HbA. Ces hémoglobines glyquées migrent en même temps que l’HbA1c. Présentes en HPLC sur le même pic chromatographique que l’HbA1c, elles interfèrent avec son dosage. Leur élimination nécessite des procédures chimiques beaucoup plus complexes que la simple chromatographie. Pour cette raison, le dosage de l’HbA1c « vraie » devrait faire appel à une digestion enzymatique suivie d’une séparation par HPLC des peptides libérés et d’une quantification par spectrométrie de masse. Cette méthode, établie par l’IFCC (International Federation of Clinical Chemistry and Laboratory Medicine) [10], n’est pas applicable pour la mesure de l’HbA1c dans les laboratoires de routine. Avec cette technique, les résultats sont exprimés en mmol/mol d’HbA0 (Hb non glyquée) [11,12]. Ce mode d’expression est différent des pourcentages donnés par la méthode classique fondée uniquement sur l’HPLC utilisée dans l’étude Diabetes Control and Complications Trial (DCCT) et certifiée par le NGSP (National Glycohemoglobin Standardized Program) [13]. La correspondance entre les deux méthodes a été établie. Elle est indiquée sur le tableau 6.2 [9].
Aujourd’hui, les résultats fournis par les laboratoires de routine sont toujours exprimés en pourcentages (méthode dite alignée sur le DCCT). La correspondance avec la méthode IFCC peut être éventuellement fournie par le laboratoire, mais il faut savoir que le mode d’expression en mmol/ mol ne provient que de la lecture d’une table d’abaque (tableau 6.2) établissant la correspondance à partir des résultats exprimés en pourcentages. Dans ces conditions, on se demande pourquoi on essaye de faire compliqué alors que l’expression en pourcentage est admise et comprise par tous les professionnels de santé depuis de nombreuses années. En revanche, les journaux scientifiques demandent de plus en plus aux auteurs d’articles médicaux d’exprimer les résultats en mmol/mol. Heureusement, la plupart des journaux conseillent de maintenir en parallèle le mode d’expression en pourcentage pour ne pas dérouter le lecteur peu averti. En particulier, il convient de noter, que la différence entre les résultats donnés par les deux méthodes n’est pas une constante, mais qu’elle varie avec le niveau de l’HbA1c. La différence est comprise entre 1,2 et 2 %. À titre d’exemple (tableau 6.2), une HbA1c à 7 % (méthode NGSP) correspond à une valeur vraie (IFCC) de 53 mmol/mol, c’est à- dire de 5,3 % (différence = 1,7), tandis qu’une HbA1c à 10 % (méthode NGSP) correspond à 86 mmol/mol c’est-à-dire à 8,6 % (différence = 1,4). La différence entre les deux méthodes correspond au pourcentage des hémoglobines glyquées sur d’autres acides aminés que la valine située à l’extrémité aminée de la chaîne β. Ainsi, il apparaît que le pourcentage des hémoglobines glyquées différentes de l’HbA1c est plus élevé chez les sujets diabétiques bien équilibrés que chez ceux qui sont mal équilibrés. Cette observation ne facilite pas la tâche du médecin praticien. Pour cette raison, tous les arguments convergent pour inciter les laboratoires à poursuivre sur un mode d’expression simple, c’est-à dire en pourcentage. Aujourd’hui, les résultats fournis par les laboratoires de routine sont toujours exprimés en pourcentages (méthode dite alignée sur le DCCT). La correspondance avec la méthode IFCC peut être éventuellement fournie par le laboratoire, mais il faut savoir que le mode d’expression en mmol/ mol ne provient que de la lecture d’une table d’abaque (tableau 6.2) établissant la correspondance à partir des résultats exprimés en pourcentages. Dans ces conditions, on se demande pourquoi on essaye de faire compliqué alors que l’expression en pourcentage est admise et comprise par tous les professionnels de santé depuis de nombreuses années. En revanche, les journaux scientifiques demandent de plus en plus aux auteurs d’articles médicaux d’exprimer les résultats en mmol/mol. Heureusement, la plupart des journaux conseillent de maintenir en parallèle le mode d’expression en pourcentage pour ne pas dérouter le lecteur peu averti. En particulier, il convient de noter, que la différence entre les résultats donnés par les deux méthodes n’est pas une constante, mais qu’elle varie avec le niveau de l’HbA1c. La différence est comprise entre 1,2 et 2 %. À titre d’exemple (tableau 6.2), une HbA1c à 7 % (méthode NGSP) correspond à une valeur vraie (IFCC) de 53 mmol/mol, c’est à- dire de 5,3 % (différence = 1,7), tandis qu’une HbA1c à 10 % (méthode NGSP) correspond à 86 mmol/mol c’est-à-dire à 8,6 % (différence = 1,4). La différence entre les deux méthodes correspond au pourcentage des hémoglobines glyquées sur d’autres acides aminés que la valine située à l’extrémité aminée de la chaîne β. Ainsi, il apparaît que le pourcentage des hémoglobines glyquées différentes de l’HbA1c est plus élevé chez les sujets diabétiques bien équilibrés que chez ceux qui sont mal équilibrés. Cette observation ne facilite pas la tâche du médecin praticien. Pour cette raison, tous les arguments convergent pour inciter les laboratoires à poursuivre sur un mode d’expression simple, c’est-à dire en pourcentage.
Conclusion
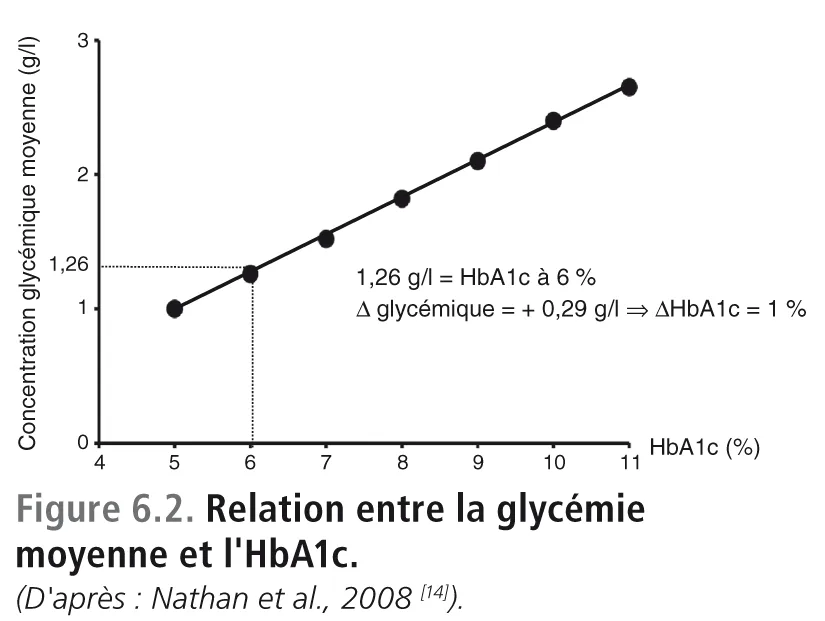
Pour clore cette section, nous insisterons à nouveau sur le fait que l’HbA1c est un marqueur de l’exposition chronique au glucose sur une période de 3 mois. Dans ces conditions, il n’est pas étonnant que son taux soit corrélé avec la glycémie moyenne évaluée par enregistrement glycémique continu sur 2 jours consécutifs toutes les 4 semaines sur une période de 3 mois. Ce travail, publié il y a quelques années par David Nathan et al. (étude ADAG, A1c-Derived Average Glucose) [14], sert aujourd’hui de référence pour établir la correspondance entre HbA1c et glycémie moyenne [6] ( figure 6.2 ).
Nous verrons ultérieurement comment cette courbe de correspondance peut être utile en pratique médicale courante quand on se pose des questions sur le taux d’HbA1c trouvé chez un individu donné. Ceci nous conduit logiquement à discuter des discordances entre HbA1c et résultats de l’autosurveillance glycémique en prenant trois exemples, l’un chez un patient diabétique de type 1 et les deux autres chez des personnes ayant un diabète de type 2.
Cas cliniques
Discordance chez une patiente ayant un diabète de type 1
Chez une jeune femme diabétique de 19 ans, le diabète s’est révélé de manière brutale à l’âge de 12 ans par la symptomatologie classique associant : syndrome polyuro- polydipsique , amaigrissement et polyphagie . Depuis cette date, elle est traitée par un schéma insulinique de type basal-bolus avec une injection d’insuline glargine U100 (Lantus®) avant le dîner et trois bolus d’insuline lispro (Humalog®) avant chaque repas. Cette patiente pèse 55 kg pour une taille de 162 cm (index de masse corporelle : 21 kg/m 2 ). Les doses moyennes d’insuline sont les suivantes :
7 unités de lispro le matin avant le petit déjeuner ;
6 unités de lispro avant le repas de midi ;
8 unités de lispro avant le dîner ;
12 unités de glargine U100 avant le dîner.
Le total des doses quotidiennes est en moyenne de 33 unités soit 0,6 unité/kg de poids corporel par jour.
Cette patiente est vue en consultation tous les trimestres. Son HbA1c est en général aux alentours de 9 %. Elle signale la survenue d’hypoglycémies symptomatiques une fois par semaine, sans horaire bien précis, mais se situant plutôt en fin de matinée. Depuis le début de sa maladie, il lui est conseillé de surveiller ses glycémies trois fois par jour, avant chaque repas. Par ailleurs, une fois par semaine, il lui a été demandé de réaliser un profil glycémique à sept points avec trois glycémies préprandiales, trois glycémies postprandiales et une glycémie supplémentaire avant le coucher.
À chaque consultation, elle présente à son médecin son carnet de surveillance sur lequel elle enregistre les glycémies. Toutes les cases sont correctement remplies. Le carnet est bien tenu, propre, sans aucune tache, en particulier sans tache de sang. Les derniers profils glycémiques à sept points, moyennés sur les trois derniers mois donnent les résultats suivants :
glycémie avant le petit déjeuner = 1,20 g/l ;
glycémie après le petit déjeuner = 1,80 g/l ;
glycémie avant le repas de midi = 1,10 g/l ;
glycémie après le repas de midi = 1,50 g/l ;
glycémie avant le dîner = 1,20 g/l ;
glycémie après le diner = 1,60 g/l ;
glycémie avant le coucher = 1,35 g/l.
La moyenne glycémique sur 24 heures, calculée à partir de ces profils glycémiques à sept points, donne un résultat à 1,4 g/l. Le résultat de la dernière HbA1c est à 9,2 % (mesurée par la méthode de référence alignée sur le DCCT en utilisant une HPLC avec échange d’ions).
Les résultats montrent indiscutablement une discordance entre l’HbA1c qui est à 9,2 % et les moyennes glycémiques qui sont à 1,4 g/l si on se réfère à la relation entre les moyennes glycémiques et l’HbA1c établie à partir des données de l’étude ADAG [14] . Si on considère que c’est le résultat du dosage de l’HbA1c qui est exact (9,2 %), les glycémies moyennes devraient être aux alentours de 2 g/l ( figure 6.2). En revanche, si on considère que ce sont les glycémies moyennes qui sont exactes (1,40 g/l), le taux de l’HbA1c devrait être aux alentours de 7 %, voire légèrement en dessous.
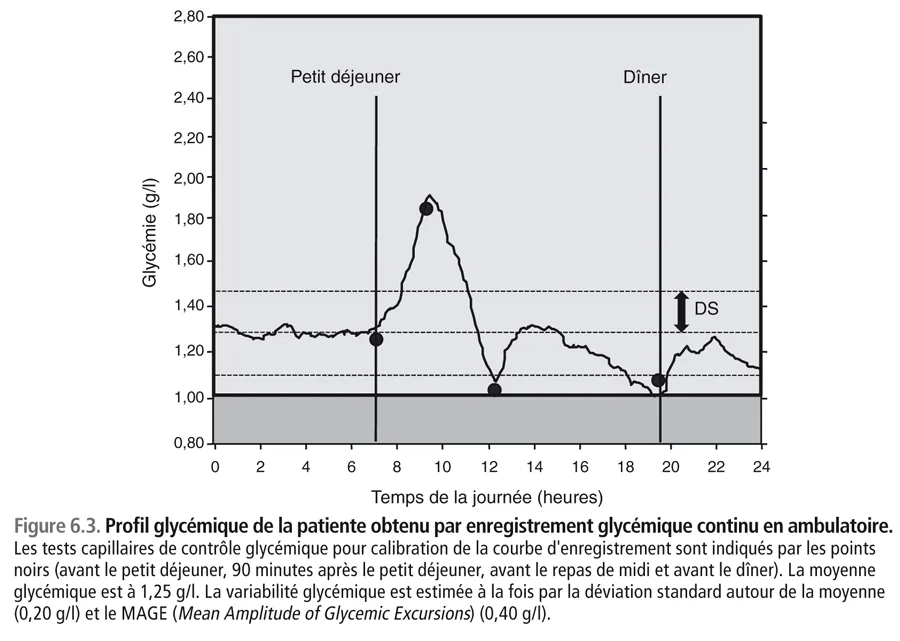
Pour essayer d’expliquer cette discordance, on décide de faire un holter glycémique en ambulatoire, qui donne le résultat indiqué sur la figure 6.3 . Pour calibrer son holter, on a demandé à cette jeune patiente de faire au moins quatre contrôles glycémiques dans la journée avec son lecteur de glycémie : avant le petit déjeuner, 90 minutes après le petit déjeuner, avant le repas de midi et avant le dîner. L’analyse des résultats du holter montre que la glycémie moyenne est effectivement aux alentours de 1,25 g/l. La variabilité glycémique [15, 16] estimée par la déviation standard autour de la moyenne glycémique (DS) est égale à 0,20 g/l, tandis que le MAGE (Mean Amplitude of Glycemic Excursions) est à 0,40 g/l.
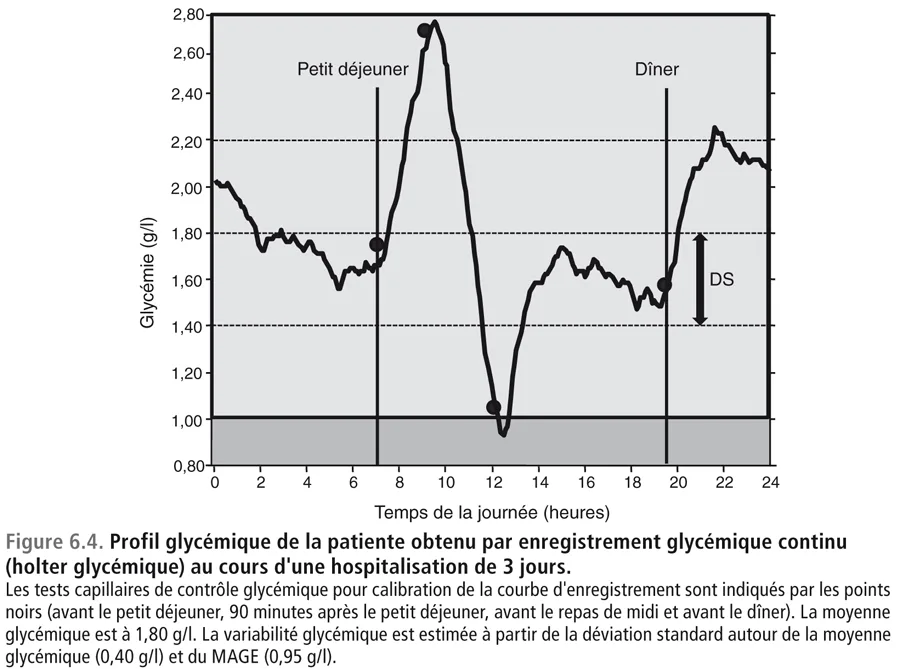
Ces résultats restant discordants avec ceux de l’HbA1c, on décide de faire hospitaliser cette patiente pendant 3 jours pour réaliser un holter en hospitalisation. Les contrôles glycémiques capillaires au bout du doigt sont réalisés par une infirmière, de manière parallèle avec le lecteur de glycémie de la patiente et celui du service hospitalier. Les valeurs trouvées sont superposables et sont introduites dans le moniteur du holter par l’infirmière elle-même. En revanche, l’adaptation des doses d’insuline et les injections d’insuline sont réalisées par la patiente, sans l’aide de l’infirmière. Le moniteur donne les résultats indiqués sur la figure 6.4.
La moyenne glycémique se situe aux alentours de 1,80 g/l. La variabilité glycémique estimée à partir de la déviation standard autour de la moyenne glycémique est égale à 0,40 g/l tandis que le MAGE est à 0,95 g/l.
Ces résultats conduisent aux questions suivantes :
Pourquoi y a-t-il une discordance entre les résultats de l’HbA1c et ceux de l’autosurveillance glycémique ?
Le holter a-t-il apporté des renseignements supplémentaires ? Si oui, lesquels ?
Pensez-vous qu’ils vont modifier votre première impression ?
Réponses aux questions soulevées par le cas clinique
Pourquoi y a-t-il une discordance entre les résultats de l’HbA1c et ceux de l’autosurveillance glycémique ? Quelles causes faut-il évoquer ?
Comme nous l’avons déjà indiqué dans l’énoncé du cas clinique, la discordance est évidente. Nous demandons à nouveau au lecteur de cet article de se reporter à la droite de corrélation entre la moyenne glycémique et l’HbA1c (figure 6.2).
Cette relation a été établie par l’étude ADAG [14] dans une large population de diabétiques constituée de patients ayant soit un diabète de type 1 (n = 335), soit un diabète de type 2 (n = 236).
Plusieurs explications peuvent être avancées pour expliquer cette discordance :
un problème technique avec un dosage de l’HbA1c qui n’est pas fiable ;
un lecteur de glycémie qui donne des résultats aberrants ;
des contrôles qui sont falsifiés par la patiente lorsqu’elle les retranscrit sur son carnet de surveillance glycémique ;
une autosurveillance qui n’est pas pratiquée, avec des résultats de glycémie qui sont carrément inventés par la patiente.
Problème technique au niveau du dosage de l’HbA1c
L’attribution de la discordance à un dosage de l’HbA1c qui ne serait pas fiable paraît peu probable, voire impossible. Les dosages actuels de l’HbA1c pratiqués par HPLC, alignés sur le DCCT et certifiés conformes au NGSP [13], sont d’une excellente fiabilité. Le coefficient de variation inter-essais à l’intérieur d’un même laboratoire est en général inférieur à 3 % et entre laboratoires inférieur à 5 %. Enfin, le coefficient de variation intra-individuel est en général inférieur à 2 % [4]. Toutes ces raisons sont suffisantes pour écarter une erreur au niveau du dosage de l’HbA1c. Cette affirmation paraît d’autant plus vraie que, chez cette patiente, les résultats oscillent depuis déjà plusieurs années autour de 9 %.
Problème lié à la présence d’une affection qui perturbe le métabolisme de l’hémoglobine
Toute maladie qui perturbe le métabolisme ou la durée de vie des globules rouges est capable d’entraîner une perte de fiabilité du dosage de l’HbA1c en tant que marqueur de l’équilibre glycémique chez un diabétique [17–21]. Toute anémie, quelle qu’en soit la cause, toute hémolyse, toute transfusion sanguine récente, tout traitement par érythropoïétine qui accélère le « turn-over» des globules rouges, sont autant de conditions pathologiques qui entraînent une sous-estimation de l’HbA1c.
L’insuffisance rénale chronique est une situation particulière car elle est souvent associée à une anémie et à un traitement par érythropoïétine qui est souvent prescrit pour accélérer l’érythropoïèse. Ainsi, dans cette maladie, sont associées deux des conditions qui entraînent une sous-estimation de l’HbA1c [22].
La présence d’une hémoglobinopathie peut également interférer avec le dosage de l’HbA1c. Selon que le variant génétique de l’hémoglobine est co-élué ou non avec l’HbA1c, sa présence peut augmenter de manière artéfactuelle le taux de l’HbA1c ou, au contraire, le diminuer en dehors de toute anémie au moment du prélèvement. En général, il s’agit surtout d’une diminution, car l’hémoglobinopathie s’accompagne en général d’une anémie. Une mise au point récente (mai 2015)2 décrit les effets des différents variants de l’hémoglobine (HbC, HbS, HbE, HbD) et de l’augmentation du taux de l’hémoglobine foetale (HbF) sur les différentes méthodes de dosage de l’HbA1c. En dehors de certaines maladies (leucémies, thalassémies), certains individus peuvent avoir une persistance de l’hémoglobine fœtale (HbF) à des taux supérieurs à 30% (normalité : 0,5 % chez l’adulte) sans avoir aucun signe clinique. La plupart des méthodes utilisées pour le dosage de l’HbA1c donnent des pics séparés pour l’HbA1c et pour l’HbF. Ainsi, un dosage de l’HbF devrait être réalisé quand on est en présence d’un taux d’HbA1c bas et inexpliqué chez un diabétique n’ayant aucun trouble pouvant évoquer une maladie sanguine. La simple HPLC avec échange d’ions permet normalement d’identifier ce pic et d’évaluer le pourcentage de l’HbF [20]. Si un diabétique est porteur de l’une de ces anomalies, il faut évidemment choisir une méthode où la présence de cette hémoglobine anormale n’interfère pas avec le dosage de l’HbA1c. Le recours au dosage des fructosamines est une solution qui permet de contourner les difficultés liées à la présence d’une hémoglobinopathie [18].
Dans le cas de notre patiente, les examens complémentaires ne montrent pas d’anémie. Les globules rouges sont de taille et de forme normales : absence de microcytose comme dans la thalassémie, absence de déformation des érythrocytes comme dans la drépanocytose. Le taux de l’HbA1c de cette patiente est élevé (≈ 9 %), alors qu’il est en général à des niveaux anormalement faibles dans les hémoglobinopathies, les maladies hémolytiques et les affections rénales. À noter que dans le cas présent, une maladie rénale a été éliminée : la créatininémie est à un taux normal (9 mg/l), la filtration glomérulaire est à 120 ml/min/m2 et l’excrétion urinaire de l’albumine est inférieure à 20 μg/mg de créatinine.
En résumé, on peut considérer que chez cette patiente le dosage de l’HbA1c est fiable et que les taux sont régulièrement aux alentours de 9 %.
2 Disponible sur le site www.ngsp.org/interf.asp.
Problème technique au niveau du lecteur de glycémie
Cette hypothèse peut être écartée puisque les résultats donnés par le lecteur de glycémie de la patiente sont superposables à ceux fournis par le lecteur de glycémie utilisé à l’hôpital, lorsqu’ils sont manipulés tous les deux de manière concomitante par l’infirmière du service.
Problème lié à une falsification des tests glycémiques par la patiente
Après avoir éliminé tous les autres problèmes, l’explication la plus probable est celle d’une falsification ou d’une non-réalisation des tests glycémiques. Ce problème est assez souvent rencontré chez les jeunes patients diabétiques qui, soit par déni de la maladie soit plus simplement pour éviter les contraintes inhérentes à l’autosurveillance glycémique, inventent des résultats imaginaires qu’ils reportent sur leur carnet de surveillance glycémique. Un carnet trop propre, en apparence trop bien tenu avec des résultats consignés toujours avec le même stylo, fait suspecter ce type comportement. Le plus souvent le (ou la) jeune patient(e) nie toute manipulation des tests glycémiques lors de la consultation et assure que les contrôles glycémiques sont réellement effectués. Dans le cas présent, il a fallu deux holters glycémiques, l’un en ambulatoire, l’autre au cours d’une hospitalisation, pour prouver la discordance entre les tests glycémiques et les taux d’HbA1c.
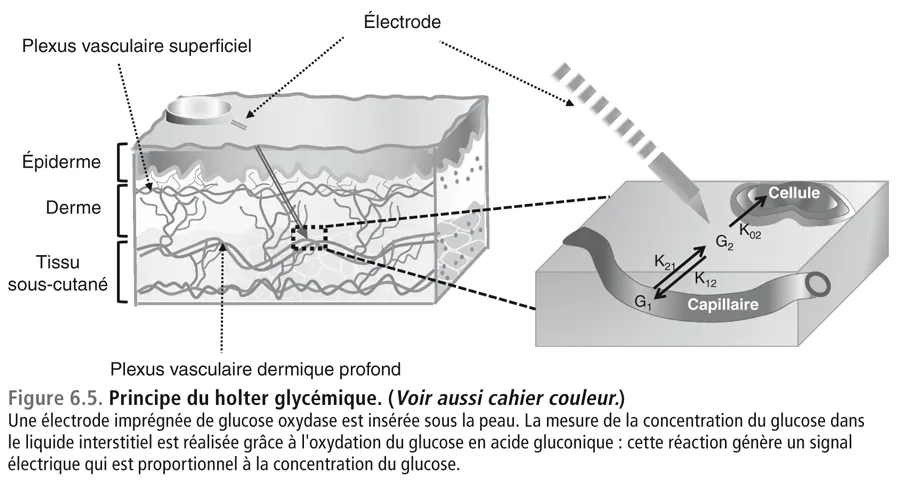
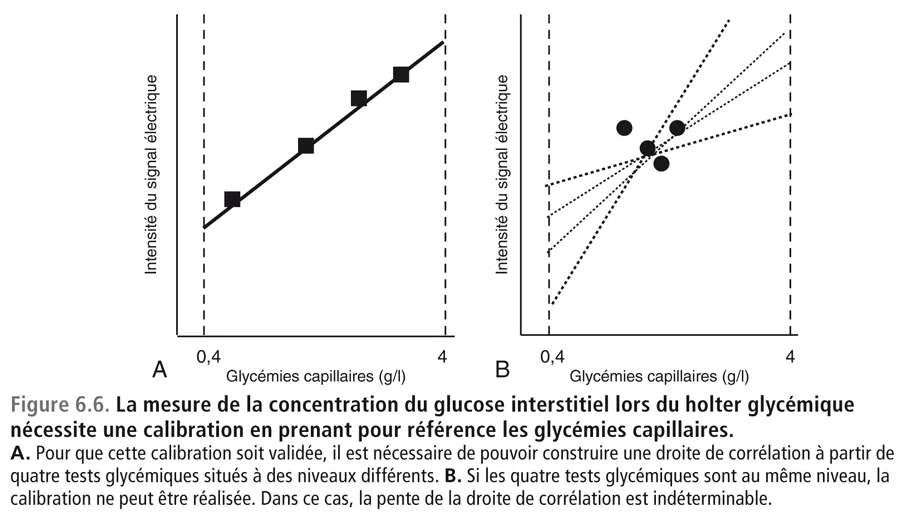
La réalisation des deux holters soulève une question : pourquoi le holter en ambulatoire est-il en désaccord avec le dosage de l’HbA1c tandis que le holter réalisé à l’hôpital est en accord ? Il convient de rappeler qu’un holter glycémique (figure 6.5, voir aussi cahier couleur) consiste à mesurer le glucose interstitiel grâce à une électrode (sensor) où la réaction enzymatique de transformation du glucose en acide gluconique, sous l’influence de la glucose oxydase fixée dans le sensor, entraîne pour chaque molécule de glucose oxydé la production de deux électrons. Le courant électrique ainsi généré a une intensité proportionnelle à la quantité de glucose qui a été oxydé c’est-à-dire à la concentration du glucose dans le liquide interstitiel [23,24]. Pour que la mesure soit valable, encore faut-il qu’elle soit calibrée en prenant pour référence des glycémies capillaires mesurées par des tests glycémiques soigneusement sélectionnés. La calibration nécessite en général plusieurs tests capillaires quotidiens choisis à des instants où les glycémies sont à des taux différents afin que le moniteur puisse calculer et valider la corrélation entre l’intensité du courant électrique et les taux glycémiques fournis par les tests capillaires. Sur la figure 6.6 nous montrons pourquoi une calibration pratiquée sur des tests capillaires à des niveaux glycémiques trop proches les uns des autres est inappropriée. Seule une calibration pratiquée sur les tests capillaires à des niveaux glycémiques différents est valable. C’est pour cette raison que l’on demande au patient de faire les tests glycémiques à la fois à des moments pré- et postprandiaux car ce sont eux qui sont susceptibles de donner les écarts les plus amples.
Il est bien évident que si le patient introduit dans le moniteur des résultats « faux » ou « imaginaires », les résultats du holter n’auront aucune valeur. C’est ce qui s’est certainement produit lorsque la patiente a réalisé son holter en ambulatoire. Dans ces conditions, les résultats du holter n’ont fait que « suivre » les données fournies par la patiente. Dans la mesure où les glycémies capillaires ont été volontairement sous-estimées, il n’est pas étonnant que le holter ait fourni un profil glycémique avec des valeurs proches de la normale (moyenne glycémique = 1,25 g/l). Ces résultats confirment la moyenne des profils glycémiques à sept points (1,40 g/l) supposés avoir été pratiqués par la patiente dans sa vie de tous les jours. Par ailleurs, la faible variabilité glycémique (DS = 0,20 g/l et MAGE = 0,40 g/l) est également surprenante car chez les diabétiques de type 1, ces deux paramètres sont en général à des niveaux deux à trois fois plus élevés.
Le deuxième holter pratiqué à l’hôpital montre des résultats franchement différents (moyenne glycémique = 1,80 g/l ; variabilité glycémique beaucoup plus élevée que celle observée sur le holter fait à domicile : DS = 0,40 g/l, MAGE = 0,95 g/l) (figure 6.4). Ce holter hospitalier ne peut être l’objet d’aucune manipulation susceptible de produire des artefacts car les tests glycémiques capillaires ont été pratiqués par l’infirmière. De plus, le chargement dans le moniteur des données nécessaires à la calibration du holter a été également réalisé par l’infirmière. Si on revient à la relation entre l’HbA1c et la moyenne glycémique établie par l’étude ADAG [14], une moyenne de 1,80 g/l correspond à une HbA1c égale à 8,3%. Bien que le résultat ne soit pas à 9 % (HbA1c de la patiente), les résultats sont indiscutablement plus cohérents. L’absence d’adéquation parfaite entre les données du holter fait en hospitalisation et l’HbA1c est certainement liée au fait que pendant l’hospitalisation les mesures diététiques de cette jeune patiente ont été mieux contrôlées que dans sa vie habituelle.
Devant ces résultats, le médecin hospitalier a un entretien avec cette jeune patiente qui reconnaît qu’elle ne faisait aucun contrôle glycémique et qu’elle remplissait son carnet avec des données imaginaires. Par voie de conséquence, elle faisait également des doses fixes d’insuline qu’elle reconduisait d’un jour à l’autre sans modification, sauf lorsqu’elle faisait des hypoglycémies. À ce moment, elle diminuait de 2 unités la dose d’insuline couvrant la période de survenue de l’hypoglycémie. Par ailleurs, il convient de souligner que la patiente n’avait jamais apporté son lecteur de glycémie lors des différentes consultations hospitalières, prétextant qu’elle le laissait à son domicile de crainte de l’égarer.
Cas clinique 7
Discordance chez une patiente ayant un diabète de type 2
Une patiente de 60 ans a un diabète de type 2 depuis 5 ou 6 ans. Elle est traitée par metformine (850 mg deux fois par jour), glimépiride (4 mg par jour) et sitagliptine (Januvia®, 100 mg par jour). Avec ce traitement, l’HbA1c est depuis plusieurs mois aux alentours de 8 %. Le poids de cette patiente est de 78 kg pour une taille de 159 cm (IMC = 30,9 kg/m2). Depuis plusieurs mois, son médecin lui demande de mieux suivre les mesures diététiques qu’elle a l’habitude de négliger le plus souvent. Son médecin lui a expliqué qu’une perte de poids de quelques kilos pourrait améliorer l’HbA1c et lui permettre d’éviter un traitement insulinique qui risque de devenir nécessaire dans un avenir relativement proche.
Tous les mois, son médecin lui demande de faire un profil glycémique à sept points avec son lecteur de glycémie. La patiente reporte les résultats sur un carnet de surveillance glycémique . Les résultats sont à peu près superposables d’un mois à l’autre, avec des taux moyens qui sont les suivants :
glycémie à jeun (avant le petit déjeuner) = 1,40 g/l ;
glycémie en milieu de matinée = 1,80 g/l ;
glycémie avant le repas de midi = 1,20 g/l ;
glycémie après le repas de midi = 1,45 g/l ;
glycémie avant le repas du soir = 1,25 g/l ;
glycémie après le repas du soir = 1,60 g/l ;
glycémie au coucher (vers 22 h 30) = 1,40 g/l.
Le dernier bilan biologique pratiqué au laboratoire a donné les résultats suivants :
créatininémie = 9 mg/l ;
formule sanguine strictement normale.
La moyenne glycémique, calculée à partir des profils glycémiques à sept points, est égale à 1,45 g/l, ce qui devrait correspondre à une HbA1c aux alentours de 7 % d’après la relation établie par l’étude ADAG [14]. Ainsi, il y a un décalage entre le résultat réel mesuré de l’HbA1c (8 %) et celui qui est calculé à partir de l’équivalence entre moyenne glycémique et HbA1c.
La question qui se pose est la suivante : pourquoi y a-t-il une discordance ?
Réponses aux questions soulevées par le cas clinique
Les hypothèses qui avaient été envisagées dans le premier cas clinique peuvent être à nouveau discutées.
Problème technique au niveau du dosage de l’HbA1c
La méthode utilisée est la méthode de référence alignée sur le DCCT et les résultats sont stables depuis plusieurs mois. Cette hypothèse peut être a priori éliminée.
Problème technique au niveau du lecteur de glycémie
Bien que nous ne l’ayons pas signalé au moment de la discussion de l’observation, le médecin a demandé à la patiente de faire une glycémie à jeun au laboratoire et de faire au même moment un test glycémique avec son lecteur de glycémie.
Ce jour-là, la glycémie à jeun avant le petit déjeuner (dosage sur plasma veineux) était à 1,25 g/l et la glycémie capillaire était à 1,20 g/l. Sachant que le taux capillaire est toujours un peu inférieur au taux veineux, on peut considérer que les deux valeurs obtenues sont identiques et que le lecteur de glycémie fournit une mesure fiable.
Problème lié à une maladie sanguine ou à une affection rénale
Cette hypothèse peut être écartée car le bilan pratiqué au laboratoire montre que la formule sanguine est normale (pas d’anémie). La normalité de la créatininémie (9 mg/l) permet d’exclure une affection rénale.
Le remplissage du carnet glycémique avec des valeurs fausses ou imaginaires
Cette hypothèse peut être envisagée, mais la patiente apporte à chaque consultation son lecteur de glycémie et le médecin a pu vérifier que les valeurs consignées sur le carnet de glycémie sont identiques à celles qui sont enregistrées sur la mémoire du lecteur. Une manipulation des valeurs glycémiques semble donc exclue.
Dernière hypothèse
Si le profil glycémique est exact et si le dosage de l’HbA1c est fiable, une seule explication est envisageable : la patiente, lorsqu’elle fait son profil glycémique tous les mois, fait attention à son régime pendant les quelques jours qui précèdent la journée des tests glycémiques. En effet, un suivi des mesures diététiques sur une durée de quelques jours suffit à modifier les valeurs glycémiques qui répondent rapidement et favorablement. En revanche, l’HbA1c, qui intègre l’exposition chronique au glucose sur une période de 3 mois, ne peut subir une amélioration que si les mesures hygiéno-diététiques sont respectées sur une période de plusieurs semaines, voire de 2 à 3 mois. Il est donc vraisemblable que cette patiente, ne serait-ce que pour se rassurer, fait attention à son régime pendant les quelques jours qui précèdent la pratique du profil glycémique. Ces quelques jours ne suffisent pas pour entraîner des modifications au niveau de l’HbA1c si les consignes diététiques ne sont pas respectées le reste du temps. Ce type d’observation est relativement fréquent. Il peut être mis à profit par le médecin. Dans le cas présent, ce dernier peut expliquer à cette patiente que si elle suivait les mesures diététiques de manière soutenue, son HbA1c passerait de 8 % à 7 %, c’est-à-dire le taux calculé à partir de la moyenne des profils glycémiques pratiqués tous les mois. Dans le cas spécifique de cette patiente, qui a une HbA1c à 8 % sous trithérapie orale, la question qui se pose est celle du renforcement du traitement en proposant un traitement injectable, soit un agoniste des récepteurs du GLP-1, soit une insulinothérapie basale [25–28]. En revanche, si cette patiente avait un taux d’HbA1c à 7 %, la trithérapie orale pourrait être poursuivie sans problème. Il est même possible que si cette personne consentait à perdre quelques kilos, elle pourrait réduire la posologie des antidiabétiques oraux , en particulier de la sulfonylurée (glimépiride), en raison de la possible survenue d’épisodes hypoglycémiques.
Cas clinique 8
Discordance chez un patient ayant un diabète de type 2 et des troubles associés
Un patient de 75 ans a un diabète de type 2 depuis plus de 20 ans. Au début, il a été traité par de la metformine seule (850 mg deux fois par jour). Pendant de nombreuses années, ce traitement a permis de maintenir un équilibre diabétique satisfaisant avec une HbA1c régulièrement comprise entre 6,5 et 7 %. Depuis 4 ans, ce traitement a été renforcé par la prise d’un inhibiteur de la DPP-4 (la vildagliptine, Galvus®, à la dose de 100 mg par jour) car son HbA1c était devenue régulièrement supérieure à 7 %. Grâce à cette bithérapie (metformine + vildagliptine ), l’HbA1c de ce patient se stabilise aux alentours de 7 %. Sur les derniers contrôles, l’HbA1c est trouvée à 5 % puis à 4,8 %. Le patient effectue tous les 2 à 3 jours une glycémie à jeun avant le petit déjeuner. Ses glycémies sont en général aux alentours de 1,30 g/l. Malgré la baisse récente de l’HbA1c, les glycémies à jeun sont toujours aux alentours de 1,30 g/l. Devant cette « amélioration » non espérée de l’HbA1c, le médecin traitant demande au patient d’augmenter le nombre de contrôles glycémiques et de faire un profil glycémique à quatre points au laboratoire avec dosage de la glycémie sur sang veineux. Le profil glycémique pratiqué au laboratoire donne les résultats suivants :
glycémie à jeun = 1,27 g/l ;
glycémie en milieu de matinée = 1,85 g/l ;
glycémie 2 heures après le repas de midi = 1,40 g/l ;
glycémie vers 17 h = 1,10 g/l ;
la moyenne glycémique calculée sur les quatre glycémies est à 1,40 g/l.
Bien que quatre glycémies ne permettent pas de calculer une moyenne glycémique sur 24 heures, le résultat ne permet pas d’expliquer une HbA1c aux alentours de 5%. En effet, le résultat de la moyenne glycémique serait plutôt en faveur d’une HbA1c à 7%, ce qui était le taux habituel de ce patient il y a encore quelques mois.
Le médecin demande au patient d’effectuer d’autres contrôles biologiques car le patient se sent fatigué et essoufflé à la marche. De plus, il présente depuis quelque temps une pâleur inhabituelle. Le malade ne signale aucune perte de sang au niveau des selles et il n’a aucune douleur digestive.
La créatininémie est à 11 mg/l avec une filtration glomérulaire évaluée par la formule MDRD à 75 ml/min pour 1,73 m2.
Laformule sanguine est anormale : hématies = 3,5 millions par mm3, le volume érythrocytaire est augmenté, l’Hb totale est à 8 g/dl.
Le fer sérique est normal = 110 μ g/dl.
En présence de cette anémie macrocytaire, le médecin demande un dosage de la vitamine B12 qui est à 150 pg/ml (taux normal > 300 pg/ml). Une gastroscopie est pratiquée. Elle montre la présence d’une gastrite atrophique.
Les questions qui se posent sont les suivantes :
Est-il possible chez ce patient d’évaluer l’équilibre glycémique grâce à une autre méthode que la mesure de l’HbA1c ?
La carence en vitamine B12 est-elle plus fréquente chez les patients diabétiques ?
Faut-il rechercher une autre cause d’anémie chez ce patient ?
Réponses aux questions soulevées par le cas clinique
Toutes les anémies , quelle qu’en soit la cause, s’accompagnent d’une sous-estimation du taux de l’HbA1c
La glycation de l’HbA se poursuit pendant toute la durée de vie du globule rouge, c’est-à-dire normalement pendant 120 jours. Toute hématie atteint son taux maximum d’HbA1c au bout de ce laps de temps. Chez un sujet normal, ayant une glycémie inférieure à 1 g/l à jeun et dans les périodes interprandiales, l’HbA1c ne dépasse pas 5,7%. Ce pourcentage est le reflet du taux moyen au sein d’une cohorte de globules rouges qui avance en se renouvelant en permanence par ses deux extrémités : naissance de nouveaux globules rouges et disparition des « vieilles » hématies arrivées à leur terme au bout de 120 jours. La réaction de glycation au sein d’un globule rouge est un phénomène continu un peu plus rapide dans les globules rouges jeunes que dans les globules rouges vieillissants (figure 6.1) [1] . Lorsque la durée de vie des globules rouges est raccourcie, le temps d’exposition au glucose plasmatique devient plus court et le taux de glycation au moment de la disparition des hématies est plus faible. Toute la cohorte de globules rouges étant touchée par ce phénomène, le taux moyen d’HbA1c observé dans la cohorte à un instant donné se trouve diminué. En première approximation, on peut considérer qu’une anémie qui entraîne une chute de la concentration de l’Hb totale de 3 g/ dl [22] se traduit par une baisse de l’HbA1c de l’ordre de 1 %, une valeur qui peut varier en fonction du mécanisme et de la nature de l’anémie.
Dans le cas présent, l’Hb totale du patient est à 8 g/dl et le résultat de l’HbA1c est aux alentours de 5% alors que les glycémies moyennes devraient conduire à un taux de 7%. Chez un sujet normal, le taux de l’Hb totale est de 13 g/dl. La baisse de l’Hb totale est donc de 5 g/dl par rapport à la normale (13 g/dl – 8 g/dl). La sous-estimation de 2% de l’HbA1c paraît tout à fait cohérente et conforme à ce que l’on peut attendre.
Comment estimer l’équilibre glycémique quand une anémie perturbe le dosage de l’HbA1c ?
Deux possibilités peuvent être envisagées. La première est d’utiliser le dosage de la fructosamine comme marqueur de la glycation[18]. La deuxième possibilité est de se baser sur les tests glycémiques capillaires. Dans le cas présent, un profil glycémique à trois points pratiqué tous les 15 jours peut suffire. Dans ce cas, comme nous l’avons expliqué dans un autre chapitre, ces trois contrôles doivent être réalisés à jeun (avant le petit déjeuner), en postprandial (90 minutes après le petit déjeuner) et en période postabsorptive (avant le dîner, en fin d’après-midi).
Carence en vitamine B12 chez le diabétique
Elle est plus fréquente chez les diabétiques que chez les non diabétiques. En premier lieu, il est bien connu que la metformine altère l’absorption de la vitamine B12. Plusieurs mécanismes ont été proposés : une altération de la motricité intestinale avec pour conséquence une prolifération bactérienne qui inactive l’absorption intestinale de la vitamine B12 ; une altération du facteur intrinsèque qui est indispensable pour l’absorption de la vitamine B12[29]. Quelle qu’en soit la cause, des études suggèrent que 6 à 9 % des patients traités au long cours par la metformine développent une carence en vitamine B12[30]. Dans le cas présent, le sujet reçoit un traitement par metformine depuis une vingtaine d’années.
La deuxième cause est la présence d’une gastrite atrophique auto-immune. Ce type de pathologie survient plutôt dans le diabète de type 1, ce qui n’est pas le cas de notre patient qui a un diabète de type 2. Toutefois, la gastroscopie pratiquée chez lui a montré la présence d’une gastrite atrophique. Cette constatation revêt une certaine importance sur le plan thérapeutique. Une carence en vitamine B12 liée à l’administration de metformine pourrait être uniquement traitée par une simple supplémentation vitaminique par voie orale. Dans la mesure où les examens ont montré la présence d’une gastrite atrophique, la correction de la carence vitaminique doit être réalisée par voie parentérale, car la vitamine B12 orale ne serait pas absorbée par manque du facteur intrinsèque gastrique.
Faut-il chercher d’autres causes d’anémie chez ce patient ?
A priori, les autres causes paraissent improbables et la carence en vitamine B12 paraît bien établie : anémie macrocytaire, taux plasmatique de vitamine B12 fortement diminué et présence d’une gastrite atrophique. L’insuffisance rénale chronique a été écartée par le dosage de la créatininémie et l’estimation de la filtration glomérulaire par la formule MDRD. Une maladie cœliaque est fortement improbable dans la mesure où ce sujet n’a pas de troubles digestifs. Le taux normal du fer sérique exclut a priori une hémorragie « distillante ». Dans ces conditions, on peut estimer que la cause a été bien identifiée. De toute manière, le traitement d’épreuve sous forme d’injections intramusculaires de vitamine B12 permettra par son efficacité d’éliminer toute ambiguïté.
Synthèse
La discordance entre HbA1c et glycémies est une observation relativement fréquente. Les causes de cette discordance sont multiples et variables. Deux situations doivent être envisagées selon que le taux de l’HbA1c est décalé vers le haut ou vers le bas par rapport aux tests glycémiques :
Quand l’HbA1c est plus élevée que ne le laisserait penser les tests glycémiques, plusieurs explications sont possibles : – explication technique : un dosage non fiable de l’HbA1c (hypothèse peu probable depuis que les dosages sont standardisés) ; un lecteur de glycémie qui donne des résultats aberrants ou bien un mauvais apprentissage du patient à la technique de lecture. Ces deux points sont en général faciles à vérifier ;
– explications liées au comportement du patient : une falsification des résultats de la part du patient (hypothèse parfois difficile à mettre en évidence) ou un meilleur suivi des consignes diététiques au moment de la réalisation des tests glycémiques alors que la compliance au régime est mauvaise le reste du temps.
Quand l’HbA1c est plus basse que ne le laisse prévoir les tests glycémiques : c’est dans ces conditions qu’il faut rechercher un trouble du métabolisme de l’hémoglobine. Toutes les anémies, quelle qu’en soit leur cause, entraînent une sous-estimation de l’HbA1c. L’insuffisance rénale chronique, les carences en vitamine B12 sont les étiologies qui doivent être recherchées. Certaines, comme la présence exagérée d’hémoglobine foetale (HbF) à l’âge adulte, sont moins évidentes car elles s’accompagnent rarement d’une anémie ; normalement, la technique d’HPLC est capable de détecter cette HbF et le laboratoire signale en général cette anomalie lors de la remise du résultat.
Vous venez de lire le chapitre 6 de l’ouvrage Diabétologie: 55 démarches cliniques en pratique médicale courante S’ouvre dans une nouvelle fenêtre

Diabétologie: 55 démarches cliniques en pratique médicale courante
Coordonné par
Louis Monnier Professeur émérite Ancien chef du service des maladies métaboliques, Montpellier Institut universitaire de recherche clinique, université de Montpellier Claude Colette Docteur ès sciences Ancienne chargée de recherche Inserm Institut universitaire de recherche clinique, université de Montpellier
Bibliographie
en savoir plus
Bunn HF, Haney DN, Kamin S, et al. The biosynthesis of human hemoglobin A1c : slow glycosylation of hemoglobin in vivo. J Clin Invest 1976 ; 57 : 1652–9.
Koenig RJ, Peterson CM, Jones RL, et al. Correlation of glucose regulation and hemoglobin A1c in diabetes mellitus. N Engl J Med 1976 ; 295 : 417–20.
Gabbay KH, Hasty K, Breslow JL, et al. Glycosylated hemoglobins and long-term blood glucose control in diabetes mellitus. J Clin Endocrinol Metab 1977 ; 44 : 859–64.
Sacks DB, Bruns DE, Goldstein DE, et al. Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus (Position statement). Diabetes Care 2002 ; 25 : 750–86.
IDF 2012 Clinical Guidelines Task Force. Global guideline for type 2 diabetes. Diabetes Res Clin Pract 2014 ; 104 : 1–52, https://www.diabetesresearchclinicalpractice. com/article/S0168-8227(12)00368-3/pdf.
American Diabetes Association Glycemic targets. Diabetes Care 2016 ; 39(Suppl. 1) : S39–46.
Svendsen PAA, Christiansen JS, Søegaard U, et al. Synthesis of glycosylated haemoglobin in vivo. Diabetologia 1981 ; 21 : 549–53.
Gorus F, Mathieu C, Gerlo E. How should HbA1c measurements be reported ? Diabetologia 2006 ; 49 : 7–10.
Sacks DB. Measurement of HbA1c. A new twist on the path to harmony. Diabetes Care 2012 ; 35 : 2674–80.
Jeppson JO, Kobold U, Barr J, et al. International Federation of Clinical Chemistry and Laboratory Medicine (IFCC). Approved IFCC reference method for the measurement of HbA1c in human blood. Clin Chem Lab Med 2002 ; 40 : 78–89.
Mosca A, Goodall I, Hoshino T, et al. International Federation of Clinical Chemistry and Laboratory Medicine, IFCC Scientific Division. Global standardization of glycated hemoglobin measurement : the position of the IFCC Working Group. Clin Chem Lab Med 2007 ; 45 : 1077–80.
Nordin G, Dybkaer R. International Federation of Clinical Chemistry And Laboratory Medicine, IFCC Scientific Division. Recommendation for term and measurement unit for “HbA1c”. Clin Chem Lab Med 2007 ; 45 : 1081–2.
Little RR, Rohlfing CL, Wiedmeyer HM. et al. ; NGSP Steering Committee. The national glycohemoglobin standardization program : a five-year progress report. Clin Chem 2001 ; 47 : 1985–92.
Nathan DM, Kuenen J, Borg R, et al. Translating the A1c assay into estimated average glucose value. Diabetes Care 2008 ; 31 : 1473–8.
Rodbard D. New and improved methods to characterize glycemic variability using continuous glucose monitoring. Diabetes Technol Ther 2009 ; 11 : 551–65.
Weber C, Schnell O. The assessment of glycemic variability and its impact on diabetes-related complications : An overview. Diabetes Technol Ther 2009 ; 11 : 623–33.
Gillery P. Le dosage de l’hémoglobine A1c en 2013. Médecine des maladies Métaboliques 2013 ; 7 : 256–61.
Gillery P, Hue G, Bordas-Fonfrède M, et al. Dosage de l’hémoglobine A1c et hémoglobinopathies : problèmes posés et conduite à tenir. Ann Biol Clin 2000 ; 58 : 425–9.
Schnedl WJ, Krause R, Halwachs-Baumann G, et al. Evaluation of HbA1c, determination methods in patients with hemoglobinopathies. Diabetes Care 2000 ; 23 : 339–44.
Little RR, Roberts WL. A review of variant hemoglobins interfering with HbA1c measurement. J Diabetes Sci Technol 2009 ; 3 : 446–51.
Jaisson S, Leroy N, Desroches C, et al. Interference of the most frequent haemoglobin variants on quantification of HbA1c : Comparison between the LC-MS (IFCC reference method) and three routinely used methods. Diabetes Metab 2013 ; 39 : 363–9.
Peacock TP, Shihabi ZK, Bleyer AJ, et al. Comparison of glycated albumin and hemoglobin A1c levels in diabetic subjects on hemodialysis. Kidney Int 2008 ; 73 : 1062–8.
McGarraugh G. The chemistry of commercial continuous glucose monitors. Diabetes Technol Ther 2009 ; 11(Suppl. 1) : S17–24.
Gengiz E, Tamborlane WV. A tale of two compartments interstitial versus blood glucose monitoring. Diabetes Technol Ther 2009 ; 11(Suppl. 1) : S11–6.
Heine RJ, Van Gaal LF, Johns D, et al. Exenatide versus insulin glargine in patients with suboptimally controlled type 2 diabetes : a randomized trial. Ann Intern Med 2005 ; 143 : 559–69.
Davies MJ, Donnelly R, Barnett AH, et al. Exenatide compared with long-acting insulin to achieve glycaemic control with minimal weight gain in patients with type 2 diabetes : results of the Helping Evaluate Exenatide in patients with diabetes compared with Long-Acting insulin (HEELA) study. Diabetes Obes Metab 2009 ; 11 : 1153–62.
Russell-Jones D, Vaag A, Schmitz O, et al. Liraglutide vs insulin glargine and placebo in combination with metformin and sulfonylurea therapy in type 2 diabetes mellitus (LEAD-5 met + SU) : a randomised controlled trial. Diabetologia 2009 ; 52 : 2046–55.
Diamant M, Van Gaal L, Stranks S, et al. Once weekly exenatide compared with insulin glargine titrated to target in patients with type 2 diabetes (DURATION-3) : an open-label randomised trial. Lancet 2010 ; 375 : 2234–43.
Angelousi A, Larger E. Anaemia, a common but often unrecognized risk in diabetic patients : a review. Diabetes Metab 2015 ; 41 : 18–27.
Pierce SA, Chung AH, Black KK. Evaluation of vitamin B12 monitoring in a veteran population on longterm, high dose metformin therapy. Ann Pharmacother 2012 ; 46 : 1470–6.