Douleurs lombaires : raison principale des arrêts de travail
France | 10 octobre 2017
Par Anne Claire Nonnotte
Nous vous proposons de découvrir un extrait de l'ouvrage Manuel pratique d'algologie S’ouvre dans une nouvelle fenêtre sur les douleurs lombaires

Manuel pratique d'algologie
Définitions et épidémiologie
La lombalgie est un symptôme très fréquent, dont la prévalence dans la population générale se situe entre 60 à 90 %. Dans la majeure partie des cas, il s’agit de lombalgies mécaniques, limitées dans le temps et évoluant favorablement dans les 4 à 6 semaines après leur apparition. Les douleurs lombaires ont un impact socioéconomique important : première cause d’invalidité chez les personnes de moins de 45 ans, elles constituent la raison principale des arrêts de travail et motivent de nombreuses consultations et examens médicaux.
On distingue quatre types de lombalgies :
les lombalgies aiguës d’une durée inférieure à 6 semaines ;
les lombalgies subaiguës qui durent 6 à 12 semaines ;
les lombalgies chroniques d’une durée supérieure à 3 mois ;
les lombalgies récidivantes.
On estime que 5 à 10 % des patients souffrant de symptômes aigus développeront des lombalgies chroniques, sous l’influence de mécanismes de sensibilisation nerveuse centrale et périphérique.
Ce faible pourcentage est néanmoins responsable des coûts socioéconomiques les plus élevés, environ 90 % des coûts totaux engendrés par les lombalgies. Il est donc primordial d’empêcher la chronicisation par une prise en charge précoce et efficace. La lombalgie subaiguë représente une période charnière durant laquelle il est important d’intensifier le traitement.
Des signaux d’alarme, qu’il faut rechercher activement lors de l’anamnèse, permettent d’identifier les patients présentant des lombalgies d’origine non mécanique potentiellement graves (drapeaux rouges) ou à risque de chronicisation (drapeaux jaunes, noirs ou bleus). En présence de drapeaux rouges, un examen médical précoce et des examens complémentaires sont indiqués. Les facteurs de risque de passage à la chronicité incluent des facteurs liés à l’épisode lui-même (intensité de la douleur, extension de la zone douloureuse, récidive douloureuse) et des facteurs liés à l’environnement sociopsychologique au moment de l’épisode.
Drapeaux rouges (red flags) : signes évocateurs de lombalgies non mécaniques et critères de sévérité
âge < 20 ans ou > 50 ans ;
antécédents oncologiques ;
inappétence, perte de poids ou diminution de l’état général ;
traumatisme ayant précédé l’apparition des douleurs ;
douleur d’intensité croissante, non calmée par le repos ;
douleur principalement nocturne et génératrice d’insomnie ;
raideur matinale d’une durée > 1 heure ;
état fébrile ;
injections récentes (médicaments, drogues, transfusion) ;
infections simultanées (urinaires, cutanées, autres) ;
traitement de cortisone de longue durée, immunodéficience ;
signes neurologiques (syndrome de la queuede- cheval , parésie ou amyotrophie).
Drapeaux jaunes (yellow flags) : facteurs psychologiques et comportementaux
état dépressif, anxiété, stress ;
fausses croyances concernant le mal de dos ;
attentes excessives concernant les traitements ;
attitude passive face à la maladie.
Drapeaux noirs (black flags) : facteurs occupationnels ou environnementaux
insatisfaction au travail ;
chômage ;
conflits assécurologiques ;
faible soutien social dans l’environnement de travail ;
arrêt de travail > 8 jours ;
mauvaise ergonomie au travail (posture inadéquate, port de charges répété) ;
faible qualification professionnelle ;
inadéquation entre travail et salaire.
Drapeaux bleus (blue flags) : en relation avec le patient
âge ;
sexe ;
données anthropométriques ;
condition physique ;
tabagisme ;
localisation de la douleur.
Les signes de douleurs non organiques (signes de Waddel ) et de kinésiophobie sont également recherchés lors de l’examen clinique du patient lombalgique.
Prévention
En prévention primaire, aucune intervention n’a montré son efficacité pour diminuer la fréquence de survenue d’un premier épisode de lombalgie.
En prévention secondaire, soit après l’apparition d’un premier épisode de lombalgie, la pratique sportive régulière, de préférence axée sur les sports d’endurance (vélo, natation, ski de fond), permet de diminuer la fréquence de survenue d’une récidive. Aucune autre technique (ceinture ou support lombaire) n’a démontré son efficacité.
Prescription d’examens complémentaires
Les examens complémentaires, notamment radiologiques, ne sont généralement pas indiqués dans la phase aiguë et en l’absence de critères de gravité (red flags). En effet, il est fréquent de trouver des anomalies sur les examens IRM des patients ne présentant aucun symptôme douloureux. Une étude a noté la présence d’une hernie discale chez 36 %, une sténose canalaire chez 21 %, et des discopathies dégénératives avec ou sans prolapsus discal chez plus de 90 % des personnes asymptomatiques âgées de 60 ans et plus [1].
Les examens radiologiques doivent donc toujours être prescrits en fonction des symptômes et des signes cliniques [2]. Dans une autre revue, l’incidence de canal lombaire étroit asymptomatique dans une population âgée de 40 ans atteint les 10 à 15 %. En outre, il n’existe aucune évidence qu’un diagnostic anatomique précis améliore le devenir des patients chez qui on a correctement diagnostiqué une lombalgie chronique mécanique ou aspécifique.
Étiologies des lombalgies d’origine non mécanique
maladies rhumatismo-inflammatoires : spondylarthrites séronégatives (maladie de Bechterew ) ;
traumatismes ;
infections : spondylodiscites , abcès épiduraux ;
tumeurs : métastases osseuses, plus rarement tumeurs osseuses primaires ;
maladies malformatives du rachis ;
maladies viscérales : atteinte retropéritonéale et urogénitale ;
maladies métaboliques.
Étiologie des lombalgies mécaniques
L’étiologie des lombalgies mécaniques ou, en d’autres termes, la structure génératrice des douleurs, ne peut être identifi ée que dans 20 % des cas. Les causes identifiées incluent les syndromes myofasciaux, les syndromes radiculaires, les sténoses canalaires ou foraminales, les syndromes facettaires, l’instabilité rachidienne ou l’atteinte sacro-iliaque. Dans la grande majorité des cas, aucune cause objective ne peut être mise en évidence et l’on parle alors de lombalgie aspécifique. La plupart des lombalgies chroniques partagent un même point commun, le déconditionnement physique, qui se manifeste par une perte d’endurance, de la mobilité globale et de la coordination.
Douleurs d’origine myofasciale
Le diagnostic de lombalgie d’origine myofasciale a longtemps été évoqué lorsque l’examen n’objectivait aucune lésion organique. De nos jours, la pathophysiologie des douleurs myofasciales est mieux comprise. Des points gâchettes myofasciaux sont régulièrement identifiés au niveau des muscles du tronc ou des extrémités chez des patients souffrant d’une lombalgie secondaire à un syndrome facettaire ou une discopathie. Ces points gâchettes peuvent aussi en être la cause principale, par exemple lorsqu’ils sont situés au niveau des muscles paravertébraux. En effet, les contraintes exercées sur les muscles et les ligaments qui soutiennent la colonne vertébrale peuvent provoquer des lombalgies. Il existe quatre principaux groupes musculaires au niveau lombaire : les extenseurs, les fléchisseurs, les rotateurs et les fléchisseurs latéraux.
Bien que la douleur puisse se manifester à n’importe quel niveau de la colonne vertébrale, la région lombaire est plus fréquemment impliquée puisqu’il s’agit de la région qui supporte le plus de poids et subit le plus de contraintes. Un syndrome douloureux myofascial survient typiquement après un traumatisme, des contractions répétées lors de mouvements musculaires itératifs (travail ou loisir), ou des contractions induites par le stress.
Un point gâchette myofascial est défini comme une zone hypersensible au niveau d’une bande de fibres musculaires squelettiques sous tension ( figure 8.1 ). Des points de tension non douloureux latents existent chez presque tous les individus sains. En présence de circonstances favorisantes, ces points peuvent se transformer en points douloureux actifs.

Figure 8.1. Point gâchette myofascial.
La palpation d’une bande musculaire sous tension et/ou d’un nodule exquis dans la région sous tension confirme le diagnostic. Les patients localisent facilement et indiquent avec précision les points gâchettes isolés. L’examinateur reproduit aisément les douleurs habituelles du patient (localisées ou référées), par palpation ou simple pression sur les points gâchettes. Autre caractéristique diagnostique, l’existence d’une contraction rapide et localisée en réponse au pianotage ou à la percussion perpendiculaire de la zone musculaire sous tension. Des études ultrasonographiques récentes des régions musculaires sous tension ont révélé des zones hypoéchogènes correspondant aux nodules de contractions [3].
La douleur myofasciale est facilement soulagée par un traitement approprié constitué de physiothérapie, de massages, d’étirements musculaires ou d’injections musculaires d’anesthésiques locaux. Toutefois, si la cause n’est pas éliminée, les douleurs récidivent fréquemment quelques jours ou semaines plus tard.
Les AINS sont efficaces dans les phases aiguës ou subaiguës. Ils sont souvent insuffisants lors de douleurs chroniques en raison de leur mauvaise absorption par les tissus cicatriciels. Les myorelaxants sont généralement inefficaces et pourvoyeurs d’effets secondaires (sédation, somnolence, faiblesse généralisée). Les blocs facettaires et les injections épidurales peuvent être bénéfiques pour traiter les lésions du segment postérieur, respectivement antérieur, à l’origine de douleurs myofasciales. L’acupuncture et le dry needling ont été appliqués avec un certain succès dans les douleurs myofasciales. Le dry needling est une technique qui consiste à piquer dans les points gâchettes avec précision à l’aide d’une aiguille très fi ne, sans injecter de médicament.
La stimulation électrique nerveuse transcutanée (TENS) apporte un soulagement temporaire [4]. La contraction musculaire provoquée par l’« acupuncture-like » TENS a un effet identique à un massage localisé et améliore la circulation sanguine régionale [5].
L’injection d’anesthésiques locaux (lidocaïne ou procaïne 0,5 %) est recommandée pour inactiver les points gâchettes. Parmi les muscles les plus fréquemment infi ltrés fi gurent les muscles paravertébraux, les muscles iliocostaux, longissimi, multifi di et carrés des lombes. Lorsque la cible est un muscle profond, l’aiguille est dirigée perpendiculairement à la région douloureuse, car la palpation simultanée du point gâchette est diffi cile à réaliser. L’injection intramusculaire de stéroïdes est déconseillée en raison du risque de myotoxicité. La toxine botulinique A bloque la libération présynaptique d’acétylcholine au niveau de la plaque motrice et relâche le muscle cible. Son action a été bien documentée dans le traitement des douleurs myofasciales [6,7].
Douleurs radiculaires
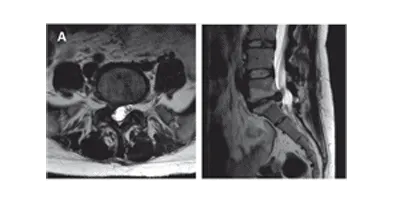
Les douleurs radiculaires sont provoquées par l’irritation et l’inflammation d’une racine nerveuse ou de son ganglion spinal. La douleur prend son origine dans la région lombaire pour irradier typiquement dans la fesse et le membre inférieur selon une distribution dermatomale. Il s’agit d’une douleur persistante aiguë, tranchante, aggravée par les mouvements, la toux ou les éternuements. L’étiologie la plus fréquente est la hernie discale (figure 8.2). Le mécanisme pathophysiologique est plus inflammatoire que compressif. L’irritation de la racine nerveuse dans le foramen intervertébral par des modifications dégénératives (sténose foraminale) est également possible.

Figure 8.2. Hernie discale S1 droite (A) et L3 gauche (B), à l’origine de douleurs radiculaires.
La douleur radiculaire n’est pas synonyme de radiculopathie. La radiculopathie est définie comme une altération de la conduction d’une racine nerveuse, pouvant se manifester par des déficits sensitifs ou moteurs, ou par des paresthésies. Les déficits moteurs (parésie ou paralysie) suivent une distribution myotomale alors que les déficits sensitifs (hypoesthésie ou anesthésie) ont une distribution dermatomale. Une radiculopathie n’est pas forcément accompagnée d’une douleur radiculaire et inversement.
Contrairement à la croyance populaire, il est souvent difficile de différencier cliniquement les hernies discales L4, L5 et S1 lorsqu’il n’existe qu’une douleur radiculaire. C’est souvent la radiculopathie qui permet de préciser l’atteinte, grâce à la distribution des troubles sensitifs et aux modifications des réflexes ostéotendineux (L3 et L4 pour le réflexe rotulien, et S1 pour le réflexe achilléen).
Le traitement pharmacologique comprend les antalgiques habituels et des adjuvants (antidépresseurs tricycliques et antiépileptiques). L’infiltration épidurale (interlaminaire ou foraminale) d’anesthésiques locaux et de corticoïdes, y compris dans la phase aiguë, apporte un soulagement transitoire qui permet de reprendre une activité ou de suivre un traitement de physiothérapie dans de meilleures conditions.
Canal lombaire étroit
L’étiologie du canal lombaire étroit acquis inclut principalement les troubles dégénératifs qui entraînent une diminution progressive du volume du canal rachidien (prolapsus ou hernie discale, hypertrophie du ligament jaune ou des articulations facettaires, lipomatose épidurale) (figure 8.3). La sténose est parfois associée à d’autres altérations dégénératives, à un spondylolisthésis, par exemple, à l’origine d’une instabilité rachidienne. La sténose peut être centrale ou localisée au niveau des récessus latéraux. Certaines formes de canal (canal en forme de trèfle), prédisposent à la sténose latérale, moins fréquente lorsque le canal est rond ou ovale.

Figure 8.3. Étiologie de la sténose canalaire acquise.
La forme congénitale se rencontre dans les cas de pédicules constitutionnellement courts. Les mécanismes pathophysiologiques incluent la compression et/ou l’ischémie des racines lombosacrées dues au rétrécissement central ou latéral du canal rachidien.
Le symptôme cardinal d’une sténose lombaire centrale est la claudication intermittente neurogène ou pseudo-claudication (par opposition à la claudication vasculaire). Les patients rapportent aussi une fatigabilité importante au niveau des cuisses ou des jambes, des paresthésies sous forme de fourmillements ou d’engourdissement, et des crampes. Les douleurs au niveau des membres inférieurs, uni- ou bilatérales, sont rarement déficitaires. La symptomatologie apparaît de façon graduelle pendant la marche, limite le périmètre de marche et oblige le patient à s’arrêter ou à s’asseoir quelques minutes avant de pouvoir poursuivre son chemin. Les douleurs de repos peuvent apparaître dans les cas sévères. À la différence de la claudication d’origine vasculaire, les limitations et les distances de marche varient en fonction des jours. La douleur est souvent plus prononcée à la descente qu’à la montée, car le patient doit se redresser lors de la marche en descente : l’augmentation de la lordose lombaire entraîne une diminution de la surface du canal rachidien. La flexion antérieure soulage les douleurs, raison pour laquelle les patients adoptent naturellement une position penchée vers l’avant (camptocormie) et prennent volontiers appui sur un déambulateur ou un chariot (signe du Caddie).
Lorsqu’une lombalgie est présente, elle est généralement sans relation avec la marche et reflète davantage la composante inflammatoire liée aux troubles arthrosiques des articulations facettaires. Le périmètre de marche est limité de manière plus importante en présence d’un canal lombaire étroit que d’une coxarthrose ou d’une gonarthrose [8].
Lors de sténose latérale, la distribution des douleurs peut être dermatomale et ressembler à une douleur radiculaire sur hernie discale foraminale.
En l’absence de signes de sévérité (syndrome de la queue-de-cheval), le traitement initial est conservateur. L’adjonction de gabapentine au traitement antalgique classique s’est révélée très modestement efficace dans une étude randomisée et contrôlée par placebo [9]. Il n’existe actuellement pas d’évidence concernant l’utilisation bénéfique des antidépresseurs tricycliques et des inhibiteurs de la recapture de la noradrénaline et de la sérotonine (SNRI). La physiothérapie et les techniques d’hygiène posturale visant à réduire la lordose lombaire peuvent être utiles. Selon une récente revue Cochrane, les données des 21 études randomisées évaluant l’efficacité des traitements conservateurs dans la prise en charge du canal lombaire étroit symptomatique ne permettent pas d’élaborer des recommandations [10].
En cas d’échec des traitements conservateurs, les investigations radiologiques permettent de guider les traitements interventionnels, voire de poser l’indication à une chirurgie de décompression. IRM et CT-scan permettent de mesurer la surface du sac dural. Le diamètre d’un canal lombaire normal se situe entre 15 et 27 mm [11] . Le sac dural est considéré comme libre lorsque le diamètre du canal est ≥ 12 mm et sa surface > 130 mm 2 . Le rétrécissement est limite lorsque le diamètre est < 10 mm et la surface < 80 mm 2 . Enfin, la compression est qualifiée de critique lorsque le diamètre est < 6 mm et la surface < 50 mm [2].
La hauteur normale d’un foramen se situe entre 20 et 23 mm. Une hauteur ≤ 15 mm indique une sténose foraminale. Comme les divergences entre surface du canal et sévérité des symptômes sont fréquentes, les chirurgiens orthopédistes de Lausanne (Suisse) ont développé une classification basée sur la morphologie du canal rachidien sur l’IRM (figure 8.4) [12].

Figure 8.4. Classification de Lausanne (selon Schizas et coll.).
La chirurgie n’est indiquée dans le traitement du canal lombaire étroit qu’en cas d’échec du traitement conservateur ou en cas d’urgence neurologique.
Les configurations de degré A (A1 à A4) sont normales, le degré B décrit une sténose relative, le degré C une sténose sévère et le degré D une sténose extrême. Les degrés C et D sont grevés d’un risque 30 fois supérieur de ne pas répondre aux traitements conservateurs.
Syndrome de la queue-de-cheval
La queue-de-cheval constitue l’ensemble des racines lombaires et sacrées, réunies dans le canal lombaire, en dessous de la terminaison de la moelle épinière. Le cône médullaire se situe habituellement à hauteur de L1-L2. Un syndrome de la queue-de-cheval peut être complet (atteinte de L3 à S5), incomplet (atteinte L5 à S5) ou latéral.
Les troubles sensitifs comprennent des douleurs de type radiculalgie (cruralgies, sciatalgies), des douleurs pluriradiculaires uni- ou bilatérales, des douleurs sacrées, périnéales et génitales favorisées par la manoeuvre de Valsalva, des paresthésies ou une anesthésie de topographie radiculaire au niveau des membres inférieurs. Il existe une hypoesthésie du périnée, des organes génitaux externes et de l’anus (anesthésie en selle) . Les troubles moteurs ont une topographie mono- ou pluriradiculaire, uni- ou bilatérale, le plus souvent asymétrique. Le défi cit moteur se manifeste par l’impossibilité de marcher sur la pointe des pieds (atteinte de la racine S1) ou sur les talons (L5), d’étendre la jambe sur la cuisse (L3, L4) ou de fléchir la cuisse sur le bassin (L1, L2). Dans les cas sévères, l’atteinte motrice peut conduire à une paraplégie fl asque avec amyotrophie. Les réflexes ostéotendineux aux membres inférieurs ainsi que les réflexes périnéaux, anaux, bulbocaverneux et clitorido-anaux sont habituellement abolis. Les troubles génitosphinctériens apparaissent précocement : difficulté à commencer la miction, nécessité de pousser pour uriner. Les mictions impérieuses avec incontinence urinaire sont fréquentes, ainsi que la perte de sensibilité pendant le passage urinaire. La constipation est plus fréquente que l’incontinence fécale. Les atteintes génitales se manifestent par une impuissance ou une anesthésie vaginale.
La hernie discale et le canal lombaire étroit représentent les causes les plus fréquentes du syndrome de la queue-de-cheval. Les épendymomes du filum terminale sont d’évolution plus lente, mais peuvent s’accompagner d’hémorragies méningées brutales à l’origine de douleurs lombaires intenses. Les neurinomes, les métastases ou les processus infectieux sont plus rares.
Le syndrome de la queue-de-cheval, confirmé par IRM, représente une urgence neurochirurgicale. Le pronostic fonctionnel, particulièrement des troubles sphinctériens, dépend de la durée et de l’intensité de la compression des racines lombosacrées. L’objectif consiste à décomprimer les racines lombosacrées par laminectomie lombaire et exérèse de la masse compressive.
Syndrome facettaire lombaire
Les articulations facettaires ou zygapophysaires sont situées postérieurement, entre deux vertèbres adjacentes. Elles sont composées du processus articulaire supérieur (issu de la vertèbre inférieure) et du processus articulaire inférieur (issu de la vertèbre supérieure). Innervées par la branche médiane du rameau dorsal, elles possèdent une grande quantité de terminaisons libres et encapsulées qui alimentent les afférences nociceptives. Les articulations facettaires contribuent à la stabilité du rachis, notamment dans les positions de torsion. Des ligaments stabilisent les articulations facettaires et préviennent les mouvements et lésions dues à des hyperflexions et des hyperextensions. Les articulations facettaires représentent 15 à 40 % des douleurs dues aux lombalgies [13,14]. Le diagnostic de syndrome facettaire est souvent difficile. Les patients se présentent typiquement avec des douleurs du bas du dos, qui irradient de manière pseudoradiculaire dans les fesses (pygalgies), dans la cuisse, la région trochantérienne ou le pli inguinal (figure 8.5).

Figure 8.5. Irradiations de la douleur d’origine facettaire.
Les irradiations en dessous du genou sont rares, mais peuvent atteindre la cheville, tout en épargnant le pied. La douleur lombaire, sous forme de barre horizontale, prédomine à celle du membre inférieur en termes d’intensité. La douleur est aggravée par l’hyperextension, la rotation, l’inclinaison latérale et la marche en montée. Les changements de position, notamment le passage de la position assise prolongée à la position debout, sont douloureux. Le dérouillage matinal et la raideur lombaire sont fréquents [15]. Jackson décrit sept facteurs corrélés de façon significative avec un syndrome facettaire : âge avancé, antécédents de lombalgie, marche normale, douleur maximale à l’extension, absence d’irradiation dans le membre inférieur, absence de spasme musculaire et absence d’impulsivité [16].
Il n’existe pas de signe radiologique pathognomonique du syndrome facettaire. Une arthrose, des ostéophytes ou une hypertrophie du ligament jaune sont parfois présentes à l’IRM ou au CTscan. Les radiographies standards (statiques et dynamiques) en vue oblique sont utiles pour mettre en évidence des signes d’instabilité rachidienne avec surcharge évidente sur les articulations facettaires. Occasionnellement, un kyste synovial adjacent à une articulation facettaire peut provoquer une sténose foraminale ou canalaire. Si l’injection de stéroïdes au niveau de la facette concernée permet la résolution du kyste dans 30 à 40 % des cas, des injections répétées sont souvent nécessaires. La prise en charge du syndrome facettaire repose sur le traitement antalgique médicamenteux (paracétamol, AINS +/- opiacés faibles), la physiothérapie, la médecine manuelle et les infiltrations facettaires des articulations postérieures responsables des douleurs. Lorsque les infiltrations sont bénéfiques, la radiofréquence ou la cryothérapie des branches médiales permettent de soulager les symptômes de manière durable.
Syndrome de la charnière dorsolombaire (syndrome de Maigne)
La jonction dorsolombaire est une région anatomique très sollicitée, car elle se situe à l’interface entre un segment mobile (la colonne lombaire) et un segment plus fixe (la colonne dorsale), sur lequel repose la cage thoracique. Contrairement à la colonne dorsale, la colonne lombaire est également beaucoup moins mobile en rotation. La vertèbre D12 est une vertèbre de transition qui possède les caractéristiques des vertèbres dorsales sur sa face supérieure et celles des vertèbres lombaires sur sa face inférieure. Les zones concernées sont le plus souvent le segment T12-L1, plus rarement T11-T12, L1-L2, parfois T10-T11. Cette atteinte segmentaire est souvent provoquée par un déséquilibre intervertébral mineur au niveau de l’articulation postérieure, parfois par une arthrose articulaire postérieure, rarement par une discopathie.
Le syndrome de Maigne se caractérise par des douleurs essentiellement référées, à distance de la colonne dorsolombaire. La plainte la plus fréquente est une lombalgie basse évoquant à tort une origine lombosacrée ou sacro-iliaque. Les douleurs référées se situent au niveau du dermatome innervé par les branches cutanées des branches latérales du rameau dorsal du nerf rachidien concerné (figure 8.6). Les branches latérales de D12 et L1 innervent la région lombaire inférieure, la partie supérieure des fesses, le pli de l’aine, le sacrum, les grandes lèvres ou le scrotum, la région trochantérienne et la face latérale de la cuisse.
Le diagnostic repose principalement sur l’examen segmentaire du rachis lombaire, tel que décrit en détail dans le chapitre 3 . Parfois, seule une discrète hypoesthésie thermique est présente en regard de la charnière dorsolombaire (signe de Foletti). Le « pincé-roulé » sur la zone cutanée référée est douloureuse. Cette manoeuvre permet de distinguer une douleur superficielle d’une douleur profonde. En présence de douleur au niveau lombaire bas ou de la hanche, la palpation de la crête iliaque latérale met en évidence le « point de crête », soit la zone de croisement entre les branches nerveuses latérales et la crête iliaque. Ce point se situe habituellement à 7 ou 8 cm de la ligne médiane dans les lombalgies basses, latéralement au-dessus du trochanter dans les douleurs référées de la hanche (figure 8.6). L’anesthésie des articulations postérieures responsables de la symptomatologie élimine les douleurs des points de crête et du « pincé-roulé » des zones cutanées correspondantes.

Figure 8.6. Innervation cutanée des branches latérales de D12 et L1. Zones douloureuses référées ou dermocellulalgies : branche cutanée postérieure (bleue), antérieure (rouge) et antérolatérale (verte) des branches latérales du rameau dorsal de D12-L1. Points de crête (flèches noires).
Le traitement du syndrome de Maigne, identique à celui du syndrome facettaire, fait essentiellement appel aux infiltrations des articulations zygapophysaires de la charnière dorsolombaire.
Douleur discogénique
La discopathie est une source fréquente de douleur lombaire chronique. Peu spécifiques, les symptômes sont essentiellement représentés par des douleurs axiales sans irradiation radiculaire [17] . Les facteurs de dégénérescence discale sont multiples : extrinsèques (surcharges, immobilisation, vibrations) ou intrinsèques (tabac, maladies vasculaires, diabète, perte d’apports nutritifs sanguins). La dégénérescence du noyau pulpeux à l’intérieur du disque s’accompagne de fissures radiales ou concentriques de l’anneau fibreux. Les mécanismes pathophysiologiques à la base des douleurs chroniques impliquent la croissance de terminaisons nociceptives en profondeur de l’anneau fibreux et la libération de molécules (damage-associated molecular patterns ou DAMPs), comme l’acide hyaluronique ou la fibronectine, capables d’induire et de maintenir durablement une inflammation stérile du disque [18] . Une infection anaérobie subclinique, favorisée par des conditions hypoxiques, pourrait également jouer un rôle dans le développement de la discopathie. Cette hypothèse a été retenue par certains auteurs qui préconisent un traitement antibiotique dans cette indication. Dans une étude randomisée, contrôlée par placebo, incluant 162 patients atteints de lombalgie chronique avec modification Modic de type 1 (figure 8.7), l’administration d’antibiotique (Bioclavid®) pendant 100 jours a apporté une amélioration très significative des douleurs après une année [19]. Dans une étude chinoise publiée en 2010, l’injection intradiscale de bleu de méthylène en cas de douleur discogénique a montré d’excellents résultats [20]. Dans une étude plus récente appliquant le même protocole, les douleurs ont diminué de 30 % chez 40 % des patients [21].
La discographie de provocation vise à reproduire la douleur habituelle du patient par l’injection sous pression de produit de contraste dans le disque suspect. L’utilité clinique de ce test est controversée en raison de sa faible spécificité. Outre les éventuelles complications liées à l’intervention, la ponction du disque atteint ou du disque contrôle est susceptible d’accélérer sa dégénérescence par atteinte structurelle, barotraumatisme ou toxicité du produit de contraste [22].

Figure 8.7. Modifications Modic de types 1 et 2 visible à l’IRM en pondération T1 et T2.
Instabilité rachidienne
Une instabilité lombaire peut être la conséquence d’une lésion osseuse vertébrale, d’une hyperlaxité ligamentaire ou d’une lésion de l’appareil discoligamentaire. Rares, les instabilités postopératoires sont surtout observées après laminectomie étendue, élargie latéralement par une foraminotomie, ouverture des recessus latéraux ou résection partielle des facettes articulaires. Les modifications de la stabilité ont des répercussions sur les trois fonctions rachidiennes principales : la statique, la dynamique et la protection des structures médullaires ou radiculaires. Même démontrés par des examens dynamiques, les signes radiologiques évocateurs de lésions dégénératives instables n’ont pas toujours une traduction clinique. L’origine dynamique d’une symptomatologie douloureuse reste difficile à documenter avec précision.
La spondylolyse lombaire touche 6 % de la population. Elle est défi nie par la perte de continuité de l’isthme articulaire (pars interarticularis) situé entre les deux apophyses articulaires supérieure et inférieure. Dans 85 à 90 % des cas, elle se situe en L5. Elle peut être uni- ou bilatérale, provoquer une micro-instabilité ou une hypermobilité de l’arc vertébral postérieur. Dans la plupart des cas, il s’agit d’une fracture de fatigue, due à des microtraumatismes répétés sur un isthme parfois congénitalement déficient. La perte de continuité s’organise sous la forme d’un tissu fibreux (plus rarement pseudokystique) appelé nodule de Gill. Le sport est incontestablement un facteur favorisant, l’incidence moyenne dans la population de sportifs de haut niveau se situe autour des 20 %. Les sports impliquant des positions en lordose, des sollicitations du rachis lombaire en hyperextension sont particulièrement concernés : plongeon acrobatique, haltérophilie, danse, aviron, gymnastique artistique, judo. Dans 50 % des cas de spondylolyse, on note une translation horizontale qui définit le spondylolisthésis (figure 8.8). Le spondylolisthésis par lyse isthmique représente un glissement antérieur du corps vertébral, accompagné de ses pédicules, des processus transverses et articulaires supérieurs. Les lames, l’épineuse et les articulaires inférieures restent dans leur position normale. Responsable d’une augmentation du diamètre antéropostérieur, la lyse isthmique n’entraîne pas de canal lombaire étroit.

Figure 8.8. Spondylolyse sur lyse isthmique L5-S1 (flèche) avec minime spondylolisthésis de L5 de degré I.
Avant la rupture, la lombalgie est due à la sollicitation excessive sur l’isthme. Après la fracture de l’isthme, la lyse et l’instabilité du disque peuvent être douloureuses. La lombalgie est typiquement mécanique, en barre horizontale basse, améliorée par la position en cyphose lombaire. La radiculalgie peut être provoquée par la sténose foraminale, l’étirement/glissement radiculaire, par les nodules fibrocartilagineux issus de la lyse (nodules de Gill), par la compression de la racine entre l’apophyse transverse et l’aileron sacré. Elle n’est pas augmentée par la manoeuvre de Valsalva, mais peut être aggravée par la marche. La radiculalgie sur lyse isthmique L5-S1 est de topographie L5.
De nombreux spondylolisthésis sont totalement asymptomatiques. Une stabilisation spontanée est également possible grâce à la formation d’un ostéophyte antérieur au niveau du sacrum.
Par opposition à la lyse isthmique, le spondylolisthésis arthrosique apparaît chez le sujet âgé. Il est dû à des lésions arthrosiques, sans rupture vertébrale. Le glissement est généralement minime, rarement supérieur à 1 cm. Le glissement simultané de l’arc postérieur et du corps vertébral provoque la diminution de la taille du canal et donc un canal lombaire étroit acquis.
Les quatre degrés de glissement sont définis par rapport au plateau sacré de S1 divisé en trois tiers : un déplacement < 1/3 définit un glissement de degré I, un déplacement entre 1/3 et 2/3 est de degré II, un déplacement > 2/3 est de degré III. Au-delà, lorsque L5 perd sa relation avec le sacrum, il s’agit d’un degré IV ou d’une spondyloptose.
En cas d’échec du traitement conservateur, le traitement chirurgical consiste en la reconstruction isthmique ou la spondylodèse. La reconstruction isthmique permet de restaurer l’anatomie et comprend l’excision du tissu fibreux d’interposition, la greffe osseuse et l’ostéosynthèse. Elle s’adresse à des patients jeunes, présentant une lyse isthmique peu déplacée et avec un disque sain. La spondylodèse est envisagée en cas d’échec des traitements médicaux et de contre-indication à la reconstruction isthmique.
Douleur persistante après chirurgie du rachis
La douleur persistante après chirurgie du rachis ou failed back surgery syndrome en anglais est un terme générique, utilisé pour décrire une évolution défavorable après une chirurgie du rachis, avec apparition ou persistance de douleur rachidienne avec ou sans irradiation dans les membres. Il n’existe pas de terme équivalent pour d’autres types de chirurgie. Les raisons de l’échec sont nombreuses, même en l’absence de complications chirurgicales. La chirurgie du rachis permet de corriger une structure anatomique génératrice de douleurs, en libérant un nerf comprimé ou en stabilisant une articulation douloureuse. Il est donc essentiel que l’étiologie douloureuse soit clairement identifiée avant la chirurgie. Une chirurgie ciblée sur une structure indolore ou visant à corriger une image radiologique non corrélée à la clinique est invariablement vouée à l’échec.
Certains types de chirurgie du rachis sont associés à de meilleurs résultats que d’autres. Par exemple, une cure de hernie discale sera plus efficace en cas de sciatalgie que lors de lombalgies pures. De même, une spondylodèse pour instabilité rachidienne aura de meilleurs résultats en cas de spondylolisthésis que lors de discopathies pluriétagées.
Parmi les autres causes de douleurs persistantes après chirurgie du rachis, on retiendra les fusions incomplètes ou insuffisantes, le syndrome du segment adjacent , les décompressions insuffisantes, les récidives de hernie discale (5 à 10 % dans les 3 mois) ou de sténose canalaire, les séquelles persistantes de compression nerveuse, les lésions nerveuses peropératoires ou le développement d’une fibrose épidurale ou périradiculaire.
Une fusion nécessite entre 3 et 12 mois pour être solide. Pour cette raison, la plupart des chirurgiens n’envisagent pas de réopération durant cette période, à moins qu’une rupture évidente du matériel d’ostéosynthèse (vis pédiculaire, par exemple) ne soit objectivée. La récidive plus tardive de douleur peut être liée à la dégénération du segment en dessous ou au-dessus du niveau fusionné. Cette dégénération du segment adjacent est plus fréquente en cas de spondylodèse sur plusieurs niveaux et chez les jeunes patients (entre 30 et 50 ans), et plus rare en cas de fusion isolée de L5-S1.
Après une chirurgie de décompression, la récupération du nerf lésé peut prendre jusqu’à 3 mois, période durant laquelle le succès de l’opération est très difficile à évaluer. Les autres symptômes neurologiques tels les paresthésies, hypoesthésies ou parésies peuvent persister beaucoup plus longtemps.
Les complications opératoires ou postopératoires sont parfois responsables de l’évolution défavorable : intervention réalisée au mauvais niveau, traumatisme nerveux peropératoire, hématome, infection, fibrose. La rééducation et les exercices d’étirement postopératoires diminuent l’apparition de fibrose épidurale ou périradiculaire. La fibrose épidurale est souvent tenue comme responsable de la persistance ou récidive de douleurs. Toutefois, son rôle est probablement surestimé, notamment chez les patients qui présentent des douleurs pré- et postopératoires identiques ou des récidives tardives. En revanche, une réapparition progressive de douleurs après une période favorable de 6 à 12 semaines peut être associée à la formation d’une cicatrice fibreuse, adhérente à la racine nerveuse. Finalement, une douleur persistante après chirurgie du rachis est parfois liée à une rééducation postopératoire insuffisante.
Douleur sacro-iliaque
L’articulation sacro-iliaque est une articulation particulière qui assure la stabilité et la mobilité du haut du corps. Son innervation complexe n’est pas encore entièrement élucidée. Le rameau dorsal de L5 et les branches latérales de S1 à S3 participent à son innervation sensitive. L’implication des articulations sacro-iliaques dans la douleur lombaire, bien reconnue de nos jours, peut être provoquée par l’arthrose, une entorse ou une enthésopathie, via des mécanismes aussi divers que des tensions ligamentaires ou capsulaires, des compressions ou des cisaillements, l’hypermobilité ou un déséquilibre myofascial.
La douleur d’origine sacro-iliaque échappe souvent au diagnostic. Elle devrait pourtant être évoquée en présence de douleurs aggravées par la position assise ou les changements de position. Pour certains patients, le décubitus latéral peut aussi être inconfortable. L’examen clinique de l’articulation sacro-iliaque est décrit dans le chapitre 3 . Dans une étude concernant 50 patients soulagés par une injection d’anesthésique local dans l’articulation, la douleur se situait dans la région fessière (94 %), la région lombaire basse (72 %), la face postérieure de la cuisse (50 %), la région sous-géniculaire (28 %) [23]. Certains patients présentaient même des irradiations douloureuses jusque dans les pieds (12 %) et dans la région lombaire haute (6 %). Il n’est toutefois pas exclu que certaines irradiations puissent être dues à une authentique douleur radiculaire, soulagée par une fuite d’anesthésique local vers les racines L4-S1, phénomène bien connu avec les infiltrations intra-articulaires sacro-iliaques. Selon plusieurs auteurs, la douleur d’origine sacro-iliaque se situe principalement dans la région fessière et irradie dans la région trochantérienne. Dans le cas d’un syndrome sacro-iliaque, notamment en cas d’atteinte bilatérale, il faut évoquer une cause rhumatismale inflammatoire, en particulier une spondylarthrite séronégative.
Christophe Perruchoud Médecin-chef, centre lémanique d’antalgie et de neuromodulation, département d’anesthésiologie, hôpital de Morges, Suisse, Médecin agréé, centre d’antalgie, service d’anesthésiologie, centre hospitalier universitaire Vaudois (CHUV), Lausanne, Suisse, Privat docent et maître d’enseignement et de recherche de l’université de Lausanne (UNIL).
Manuel pratique d’algologie S’ouvre dans une nouvelle fenêtre © 2017 Elsevier Masson SAS. Tous droits réservés.
Références
1. Boden SD , Davis DO , Dina TS . Abnormal magneticresonance scans of the lumbar spine in asymptomatic subjects. A prospective investigation . J Bone Joint Surg Am 1990 ; 72 ( 3 ) : 403 – 8 . 2. Chou R , Deyo RA , Jarvik JG . Appropriate use of lumbar imaging for evaluation of low back pain . Radiol Clin North Am 2012 ; 50 ( 4 ) : 569 – 85 . 3. Sikdar S , Shah JP , Gebreab T , et al. Novel applications of ultrasound technology to visualize and characterize myofascial trigger points and surrounding soft tissue . Arch Phys Med Rehabil 2009 ; 90 : 1829 – 38 . 4. Hsueh TC , Cheng PT , Kuan TS , et al. The immediate effectiveness of electrical nerve stimulation and electrical muscle stimulation on myofascial trigger points . Am J Phys Med Rehabil 1997 ; 76 : 471 – 6 . 5. Tanrikut A , Özaras N , Kaptan HA , et al. High voltage galvanic stimulation in myofascial pain syndrome . J Musculoske Pain 2003 ; 11 ( 2 ) : 11 – 5 . 6. Acquadro MA , Borodic GE . Treatment of myofascial pain with botulinum A toxin . Anesthesiology 1994 ; 80 : 705 – 6 . 7. Cheshire WP , Abashian SW , Mann JD . Botulinum toxin in the treatment of myofascial pain syndrome . Pain 1994 ; 59 : 65 – 9 . 8. Winter CC , Brandes M , Muller C , Schubert T , Ringling M , Hillmann A , et al. Walking ability during daily life in patients with osteoarthritis of the knee or the hip and lumbar spinal stenosis: a cross-sectional study . BMC Musculoskeletal Disorders 2010 ; 11 : 233 . 9. Yaksi A , Ozgönenel L , Ozgönenel B . The effi ciency of gabapentin therapy in patients with lumbar spinal stenosis . Spine 2007 ; 32 : 939 – 42 . 10. Ammendolia C , Stuber KJ , Rok E , Rampersaud R , Kennedy CA , Pennick V , et al. Nonoperative treatment for lumbar spinal stenosis with neurogenic claudication . Cochrane Database of Systematic Reviews 2013 ; doi: 10.1002/14651858.CD010712 . Issue 8. Art. CD010712 . 11. Ciricillo SF , Weinstein PR . Lumbar spinal stenosis . West J Med 1993 ; 158 ( 2 ) : 171 – 7 . 12. Schizas C , Theumann N , Burn A , Tansey R , Wardlaw D , Smith FW , Kulik G . Qualitative grading of severity of lumbar spinal stenosis based on the morphology of the dural sac on magnetic resonance images . Spine 2010 Oct 1 ; 35 ( 21 ) : 1919 – 24 . 13. Cohen SP , Raja SN . Pathogenesis, diagnosis, and treatment of lumbar zygapophysial (facet) joint pain . Anesthesiology 2007 ; 106 ( 3 ) : 591 – 614 . 14. Filippiadis DK , Kelekis A . A review of percutaneous techniques for low back pain and neuralgia: current trends in epidural infiltrations, intervertebral disk and facet joint therapies . Br J Radiol 2016 ; 89 ( 1057 ) : 20150357 . doi: 10.1259/bjr. 20150357 . 15. Beresford ZM , Kendall RW , Willick SE . Lumbar facet syndromes . Curr Sports Med Rep 2010 ; 9 ( 1 ) : 50 – 6 . 16. Jackson RP , Jacobs RR , Montesano PX . 1988 Volvo award in clinical sciences. Facet joint injection in lowback pain. A prospective statistical study . Spine (Phila Pa 1976) 1988 ; 13 ( 9 ) : 966 – 71 . 17. He L , Hu X , Tang Y , et al. Effi cacy of coblation annuloplasty in discogenic low back pain: a prospective observational study . Medicine (Baltimore) 2015 ; 94 ( 19 ) : e846 . 18. Quero L , Klawitter M , Schmaus A , et al. Hyaluronic acid fragments enhance the inflammatory and catabolic response in human intervertebral disc cells through modulation of toll-like receptor 2 signalling pathways . Arthritis Res Ther 2013 ; 15 ( 4 ) : R94 . 19. Albert HB , Sorensen JS , Christensen BS , Manniche C . Antibiotic treatment in patients with chronic low back pain and vertebral bone edema (Modic type 1 changes): a double-blind randomized clinical controlled trial of effi cacy . Eur Spine J 2013 Apr ; 22 ( 4 ) : 697 – 707 . doi: 10.1007/s00586-013-2675-y. Epub 2013 Feb 13 . 20. Peng B , Pang X , Wu Y , Zhao C , Song X . A randomized placebo-controlled trial of intradiscal methylene blue injection for the treatment of chronic discogenic low back pain Pain 2010 Apr ; 149 ( 1 ) : 124 – 9 . Epub 2010 Feb 18 . 21. Kallewaard JW , Geurts JW , Kessels A , Willems P , van Santbrink H , van Kleef M . Effi cacy, Safety, and Predictors of Intradiscal Methylene Blue Injection for Discogenic Low Back Pain: Results of a Multicenter Prospective Clinical Series . Pain Pract 2016 Apr ; 16 ( 4 ) : 405 – 12 . doi: 10.1111/papr.12283. Epub 2015 Mar 6 . 22. Cuellar JM , Stauff MP , Herzog RJ , et al. Does provocative discography cause clinically important injury to the lumbar intervertebral disc? A 10-year matched cohort study . Spine J 2016 ; 16 ( 3 ) : 273 – 80 . 23. Slipman CW , Jackson HB , Lipetz JS , Chan KT , Lenrow D , Vresilovic EJ . Sacroiliac joint pain referral zones . Arch Phys Med Rehabil 2000 Mar ; 81 ( 3 ) : 334 – 8 .