Imagerie des pneumopathies interstitielles diffuses (PID)
Paris | 15 décembre 2023
Les PID, un véritable défi pour le radiologue
Découvrez un extrait de l'ouvrage Imagerie des pneumopathies interstitielles diffuses (PID) S’ouvre dans une nouvelle fenêtre
Plan de l'ouvrage
I. Généralités
II. PID chroniques de cause inconnue
III. PID chroniques de cause connue
IV. PID aiguës et subaiguës
V PID rares
VI. Le futur de l’imagerie des PID
Découvrez le chapitre 18 Pneumonie interstitielle aiguë de la partie IV de l'ouvrage qui comporte 4 chapitres
16. PID de l’immunodéprimé
17. Pneumopathies médicamenteuses
18. Pneumonie interstitielle aiguë
19. PID post-radiques et toxiques)
PLAN DU CHAPITRE
Diagnostic positif
Clinique
Histologie
Imagerie
Diagnostics différentiels
Syndrome de détresse respiratoire aiguë (SDRA)
Exacerbation aiguë de FPI
DAD de cause connue
Insuffisance cardiaque congestive
Hémorragie intra-alvéolaire
Pneumonie aiguë à éosinophiles
Traitement
Pronostic
Bibliographie
Imagerie des pneumopathies interstitielles diffuses (PID) © 2023 Elsevier Masson SAS. Tous droits réservés
Pneumonie interstitielle aiguë
Isabelle Petit
Introduction
▸La pneumonie interstitielle aiguë (PIA), aussi appelée syndrome de Hamman-Rich, est une forme rare et fulminante de pneumopathie interstitielle idiopathique. ▸Elle est caractérisée cliniquement par l’apparition rapide (en quelques jours à quelques semaines) d’une insuffisance respiratoire aiguë (IRA) similaire au syndrome de détresse respiratoire aiguë (SDRA) et histologiquement par des lésions de dommage alvéolaire diffus (DAD). ▸Elle survient généralement chez des patients sans maladie pulmonaire préexistante, avec une fréquence égale chez les hommes et les femmes. L’âge moyen est de 50-55 ans. ▸ La PIA n’est pas associée au tabagisme. ▸ Son pronostic est sombre, avec une mortalité élevée de 70 % à 3 mois malgré une assistance ventilatoire.
Diagnostic positif
Les éléments clés pour poser un diagnostic de PIA sont : • l’apparition aiguë de symptômes respiratoires entraînant une hypoxie sévère et dans la plupart des cas une IRA ; • des infiltrats pulmonaires bilatéraux en imagerie ; • une documentation histologique de DAD ; • l’absence d’étiologie identifiable ou de pathologie pulmonaire sous-jacente après une investigation clinique adéquate. La PIA est donc un diagnostic d’exclusion. Pour les patients dont la fonction pulmonaire ne permet pas la réalisation d’une biopsie pulmonaire (ce qui est très souvent le cas), un diagnostic présomptif de PIA peut être posé sur la présence d’un syndrome clinique compatible, et sur l’absence d’élément clinique, sérologique ou du lavage bronchoalvéolaire (LBA) orientant vers un diagnostic alternatif.
Clinique
La PIA est souvent précédée d’une phase prodromique de type virale ou grippale (fatigue, myalgies, arthralgies). Apparaissent ensuite rapidement (1 à 3 semaines) des symptômes à type de dyspnée, de toux, d’essoufflement sévère et de fièvre (50 % des patients).
À l’examen clinique, on retrouve une tachypnée, une cyanose, une hypoxie en air ambiant et des crépitants diffus.
! Important La présence d’un hippocratisme digital suggère qu’il s’agit non pas d’une PIA, mais de l’exacerbation d’une PID fibrosante sous-jacente telle qu’une fibrose pulmonaire idiopathique (FPI).
Histologie
Les lésions de DAD apparaissent en deux phases séquentielles qui se chevauchent : • la phase exsudative aiguë (première semaine) : épaississement des septums alvéolaires par un infiltrat de cellules inflammatoires, remplissage des alvéoles par un exsudat protéinacé, développement de membranes hyalines le long des septums alvéolaires et hyperplasie des pneumocytes de type II ; • la phase fibroproliférative (deuxième semaine) : développement d’un tissu fibroblastique floride à la fois dans l’espace interstitiel et dans les espaces alvéolaires, qui se transforme en collagène mature à l’origine d’une oblitération des espaces aériens et d’un remodelage du parenchyme entraînant une dilatation des bronches. Une caractéristique histologique de la PIA est l’aspect homogène des lésions dans le temps, suggérant qu’elles résultent d’une agression unique, contrairement à la pneumonie interstitielle commune où les lésions sont d’âge différent. L’évolution se fait vers la guérison ou la fibrose.
Imagerie
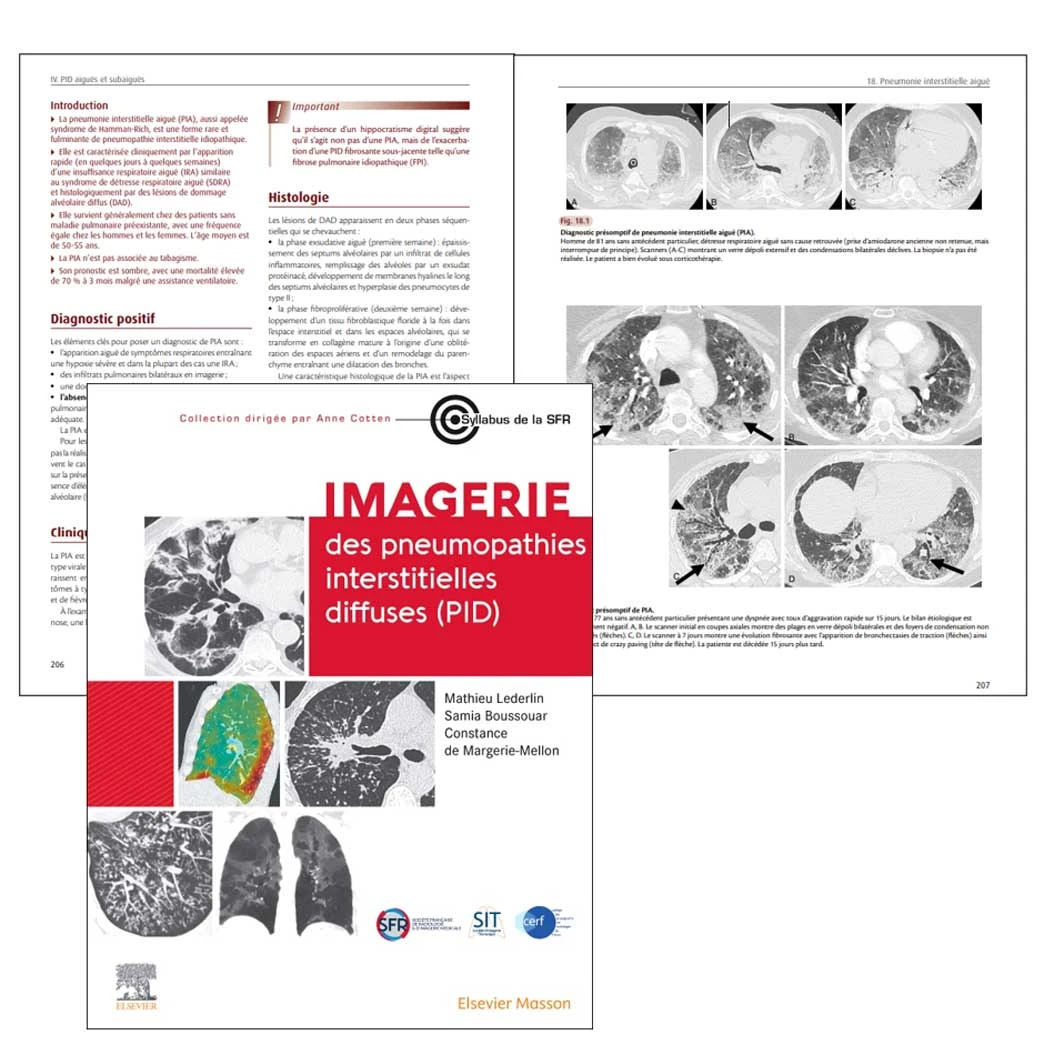
Les caractéristiques scanographiques de la PIA dérivent des lésions histologiques avec également des modifications au cours du temps. Initialement, le scanner montre des plages extensives bilatérales de verre dépoli situées dans des zones non déclives, des condensations dont la distribution évolue avec le temps : d’abord hétérogènes, patchy, elles évoluent progressivement vers des condensations gravito-dépendantes (fig. 18.1). Il s’y associe parfois du crazy paving avec une prédominance sous-pleurale. Plus tardivement, ces lésions laissent la place à des bronchectasies de traction, des opacités réticulaires, du rayon de miel et des signes de distorsion architecturale (fig. 18.2).
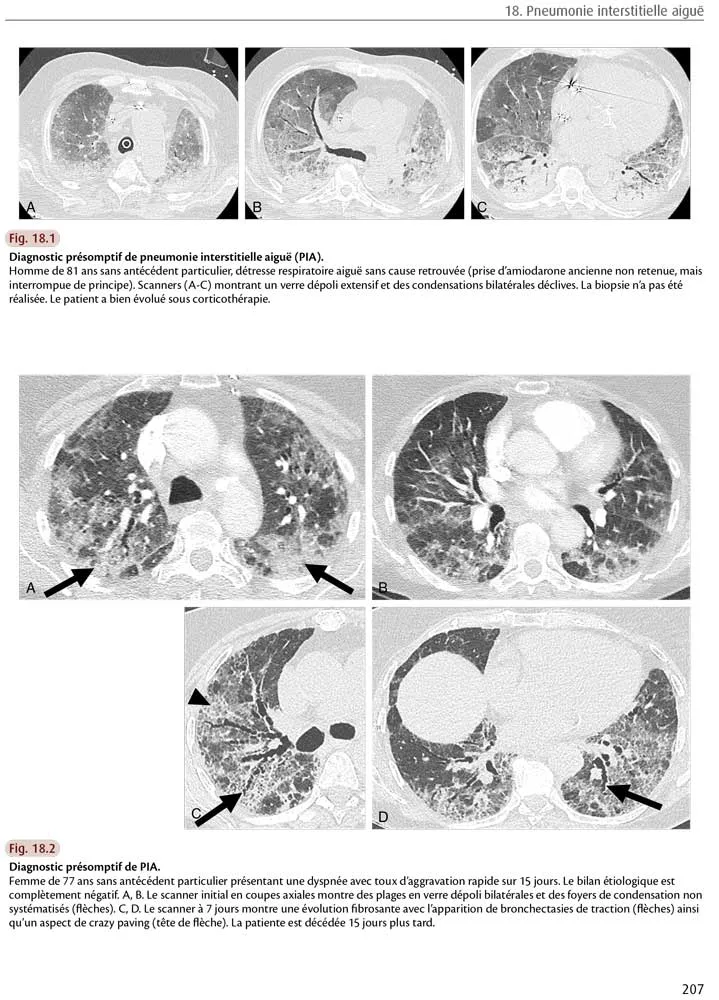
Fig 18.1 et 18.2
Devant un poumon de réanimation, le radiologue doit, dans la mesure du possible, essayer d’identifier un pattern TDM, et rechercher en particulier un aspect de PIA, mais aussi d’éventuels diagnostics différentiels (fig. 18.3). Il doit également traquer les comorbidités : pneumothorax, pneumomédiastin, emphysème sous-cutané, embolie pulmonaire, mauvais positionnement des cathéters, drains ou sondes (fig. 18.4).
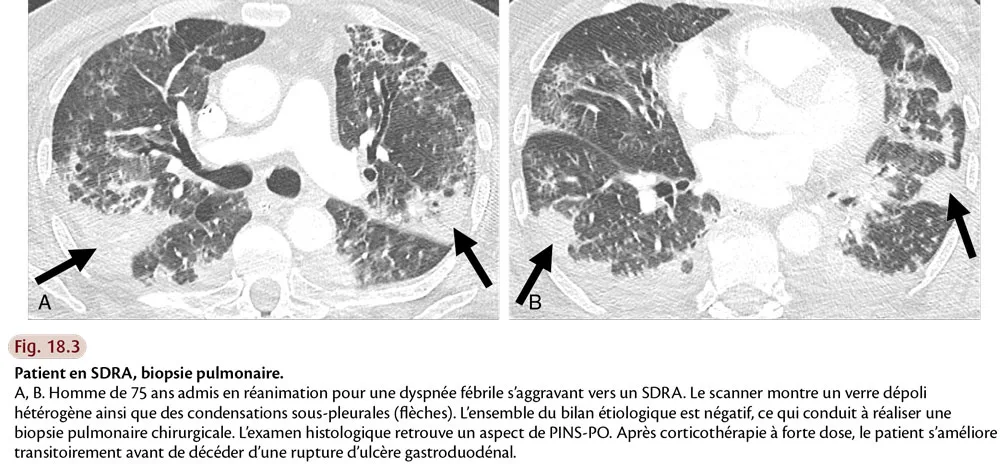
Fig.18.3
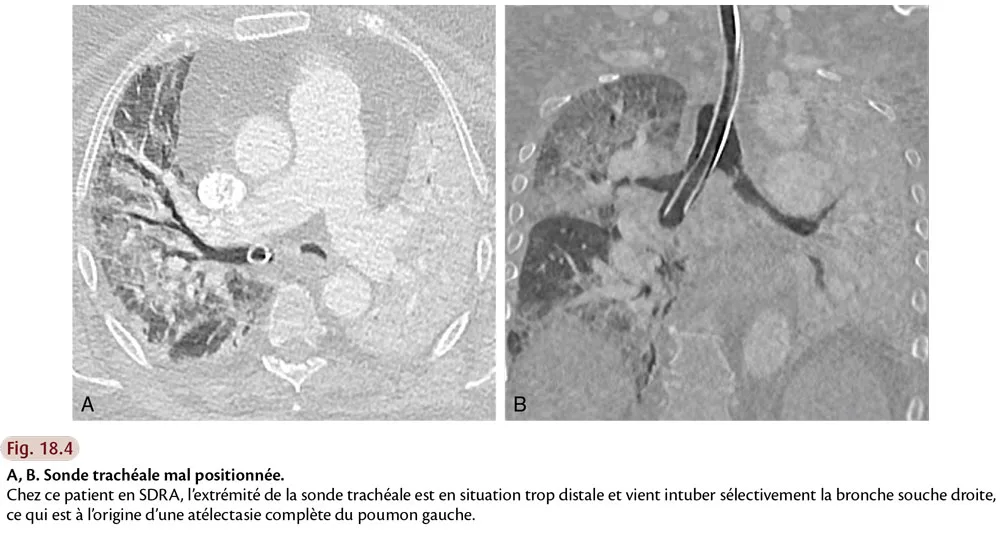
Fig.18.4
Diagnostics différentiels
Syndrome de détresse respiratoire aiguë (SDRA)
Le SDRA est défini par les critères cliniques de Ber-lin associant : un début aigu, des infiltrats pulmonaires sur la radiographie thoracique, un rapport PaO2/FiO2 ≤ 300 mmHg et l’absence d’argument pour une insuffisance cardiaque congestive. Les similitudes sont donc importantes avec la PIA, mais il existe deux différences essentielles : • d’une part, le SDRA est défini uniquement par des cri-tères cliniques, alors que le diagnostic de PIA nécessite des critères cliniques et pathologiques, rendant ainsi obligatoire l’examen histologique du poumon pour un diagnostic de certitude ; • d’autre part, la définition de la PIA exige qu’il n’y ait aucune cause sous-jacente identifiable alors que le SDRA peut être primitif ou secondaire.
La PIA possède donc une définition beaucoup plus restrictive que le SDRA, et en constitue un sous-ensemble spécifique. Les causes de SDRA sont représentées potentiellement par toutes les maladies pulmonaires aiguës existantes (infections, pneumonie organisée, pneumonie aiguë à éosinophiles, hémorragie alvéolaire, etc.), mais il existe aussi des SDRA d’origine extrapulmonaire.
PIA ≠ SDRA
■ PIA = critères cliniques (IRA) + critères histologiques (DAD) + absence de cause ■ SDRA = critères cliniques uniquement (IRA)
Exacerbation aiguë de FPI
Certains patients atteints de PID chronique fibrosante, établie ou occulte, vont développer des lésions pulmonaires aiguës qui viennent se superposer aux lésions de fibrose chronique. L’exemple le plus classique est celui des patients atteints de FPI qui développent sur cette fibrose des lésions de DAD sans que l’on en comprenne bien la cause. Bien que cette exacerbation soit histologiquement similaire à la PIA, la différence réside dans la présence d’une fibrose chronique sous-jacente, ce qui conduit à cette distinction sémantique.
DAD de cause connue
Le DAD est le substrat anatomopathologique de la PIA. La PIA est par définition idiopathique, mais il existe des causes identifiées de DAD (tableau 18.1) qui doivent être exclues avant de pouvoir étiqueter la maladie de PIA.
Tableau 18.1. Causes de dommage alvéolaire diffus (DAD).
Causes | Exemples |
|---|---|
Infections | Virus – Influenza – Herpès simplex virus de type 1 – Cytomégalovirus – Adénovirus – Virus syncitial respiratoire – SARS-CoV-2 Légionellose Champignons – Pneumocystis jirovecii – Histoplasma capsulatum |
Connectivites | Polyarthrite rhumatoïde Polymyosite/dermatomyosite Syndrome des antisynthétases Lupus érythémateux systémique Sclérodermie Connectivite mixte Syndrome de Gougerot-Sjögren |
Drogues | Amiodarone Blémoycine Busulfan Carmustine Cyclophosphamide Cytarabine Gemcitabine Nitrofurantoïne Cocaïne/héroïne Radiothérapie |
Complications non infectieuses des transplantations d’organes | |
Toxicité de l’oxygène |
Insuffisance cardiaque congestive
Cliniquement et même radiologiquement, le SDRA et la PIA peuvent parfois être difficiles à distinguer de l’œdème pulmonaire cardiogénique. Le diagnostic d’insuffisance cardiaque gauche est néanmoins facilité par l’échocardiographie et le dosage du BNP (B-type natriuretic peptide).
Hémorragie intra-alvéolaire
Voir chapitre 16.
Pneumonie aiguë à éosinophiles
Voir chapitre 21.
! Important L’objectif de la bronchoscopie et du LBA n’est pas de faire le diagnostic de PIA, mais d’exclure les diagnostics différentiels.
Traitement
Il n’existe pas de thérapie spécifique de la PIA et les essais cliniques sont difficiles à mener en raison de la rareté du diagnostic. Pratiquement tous les patients ont besoin d’une ventilation mécanique et de soins de réanimation. Le bénéfice des corticoïdes à forte dose reste incertain, bien que ceux-ci soient largement utilisés. Quelques séries ont rapporté l’utilisation de traitements immunosuppresseurs. La transplantation pulmonaire a pu être proposée chez certains patients très sélectionnés.
Pronostic
La mortalité hospitalière de la PIA est élevée, supérieure à 50 %, et la majorité des patients qui survivent à l’hospitalisation initiale meurent dans les 6 mois suivant le diagnostic. Les longs survivants peuvent avoir une récupération partielle ou complète de la fonction pulmonaire. Des récidives sont rapportées ainsi que le développement d’une PID chronique fibrosante. Aucun critère clinique ou paraclinique ne semble pouvoir prédire l’évolution chez les survivants.
Messages à retenir
■ Parmi les pneumonies interstitielles idiopathiques, la pneumonie interstitielle aiguë (PIA) est celle qui a le début le plus aigu et l’évolution la plus rapide et la plus sévère. ■ Des examens cardiaques, cutanés, articulaires et musculaires minutieux doivent être réalisés pour exclure une insuffisance cardiaque ou des causes connues de SDRA. ■ Les lésions TDM de PIA sont similaires à celles observées dans le SDRA : plages extensives bilatérales de verre dépoli, condensations déclives, crazy paving, bronchectasies de traction, réticulations périphériques et basales. ■ Il n’existe pas de traitement spécifique. Une ventilation mécanique est souvent nécessaire.
Bibliographie
Bouros D, Nicholson AC, Polychronopoulos V, du Bois RM. Acute interstitial pneumonia. Eur Respir J 2000 ; 15 : 412–8.
Hamman L, Rich AR. Fulminating diffuse interstitial fibrosis of the lungs. Trans Am Clin Climatol Assoc 1935 ; 51 : 154–63.
Ichikado K. High-resolution computed tomography findings of acute respiratory distress syndrome, acute intertitial pneumonia, and acute exacerbation of idiopathic pulmonary fibrosis. Semin Ultrasound CT MR 2014 ; 35(1) : 39–46.
Mrad A, Huda N. Acute intertistial pneumonia. Treasure Island (FL) : Stat-Pearls Publishing ; 2023.
Mukhopadhyay S, Parambil JG. Acute interstitial pneumonia (AIP) : relationship to Hamman-Rich syndrome, diffuse alveolar damage (DAD), and acute respiratory distress syndrome (ARDS). Semin Respir Crit Care Med 2012 ; 33(5) : 476–85.
Vourlekis JS. Acute interstitial pneumonia. Clin Chest Med 2004 ; 25(4) : 739–47.
Imagerie des pneumopathies interstitielles diffuses (PID) Mathieu Lederlin, Samia Boussouar, Constance De Margerie-Mellon ISBN 9782294781902
Toutes nos publications en imagerie sur elsevier-masson.fr S’ouvre dans une nouvelle fenêtre
