Spécificités de la radiothérapie
France | 30 décembre 2016
Par Anne Claire Nonnotte
Élisabeth Moerschel
1. Historique
La radiothérapie, littéralement « traitement utilisant les radiations ionisantes », est née avec la découverte des rayons X et celle de la radioactivité. Avec elles, tous les espoirs étaient permis, toutefois elle a dû rapidement faire face à de nombreuses contraintes. Aujourd’hui utilisée majoritairement dans le traitement de maladies cancéreuses, elle a fait l’objet de progrès considérables dans le domaine de la technologie des appareils, des techniques de traitement et de la dosimétrie.
1.1. Argumentaire
L’historique permet de rappeler les faits ayant marqué la radiothérapie, mais il permet surtout de comprendre quel était l’objectif des différentes avancées, tant du point de vue de la technologie des appareils que des techniques de traitement.
Depuis la découverte des radiations ionisantes jusqu’aux techniques modernes, l’objectif principal a toujours été l’optimisation des traitements pour tendre vers plus d’efficacité sur les tissus morbides avec en parallèle une meilleure préservation des tissus sains et donc moins de séquelles.
1.2. Découvertes scientifiques et « premiers pas » de la spécialité
Pour comprendre
Rappelons que, du fait des temps de pose considérables nécessaires à la prise des premiers clichés radiologiques, la peau des patients présentait des rougeurs voire des épilations : c’était la preuve des effets biologiques des rayonnements sur les tissus. Les lésions observées ont permis d’imaginer que ces rayonnements, capables de traverser la matière, pourraient être utilisés pour traiter certains cancers par des méthodes non chirurgicales.
Exemple: en 1896, à Lyon, le docteur Victor Despeignes (1866–1937) traite aux rayons de Roentgen un patient atteint d’une volumineuse tumeur à l’estomac. Après 8 jours de séances biquotidiennes de 30 minutes chacune, avec des rayons X émis sous une tension d’environ 30 kV, il décrit la réduction de la tumeur et des signes cliniques indirects ; malheureusement, le patient décède peu après.
Autre exemple: les sels de radium étaient utilisés en application, contenus dans une gaine de platine destinée à la fois à la filtration des rayonnements indésirables et à la rigidité de la source.
Il est aussi important de rappeler que le développement de la radiothérapie s’est opéré, en un peu plus d’un siècle, sur deux fronts parallèles. Cette dualité repose sur la distinction entre les rayonnements d’origine nucléaire, donc de la radioactivité, et ceux d’origine extra-nucléaire produits par des appareils électriques.
La découverte des rayons X par W.C. Roentgen en 1895 puis celle de la radioactivité par H. Becquerel en 1896 ont rapidement représenté un intérêt pour des applications médicales sur le plan thérapeutique.
Parallèlement, dès 1903, année du prix Nobel de physique de Pierre et Marie Curie, la description des actions bénéfiques des rayons du radium sur les tumeurs cancéreuses marque la naissance de la curiethérapie.
1.3. Prise de conscience
Les traitements aux rayons X, ou aux rayons gamma du radium, connaissent leurs premiers développements. Ils visent à détruire des cellules ou des tissus morbides, mais ils sont rapidement confrontés aux problèmes de la tolérance par les organismes. Les techniques et les essais de traitements font alors l’objet de nombreux débats entre physiciens et médecins qui aboutissent à la conclusion que, pour soigner des malades, la radiothérapie doit être sélective, ciblée, « bien dosée ».

Fig 9.1
Concrètement: vers 1909, l’université de Paris et l’Institut Pasteur décident de construire à frais communs l’Institut du radium, comprenant deux laboratoires, l’un entièrement consacré aux recherches en physique et en chimie dirigé par Marie Curie, l’autre dédié à l’étude des effets biologiques et médicaux des rayonnements, placé sous la direction de Claudius Regaud (figure 9.1).
1.4. Naissance de la dosimétrie
Si les effets bénéfiques des rayonnements ionisants ont été décrits, leur nocivité reste préoccupante.
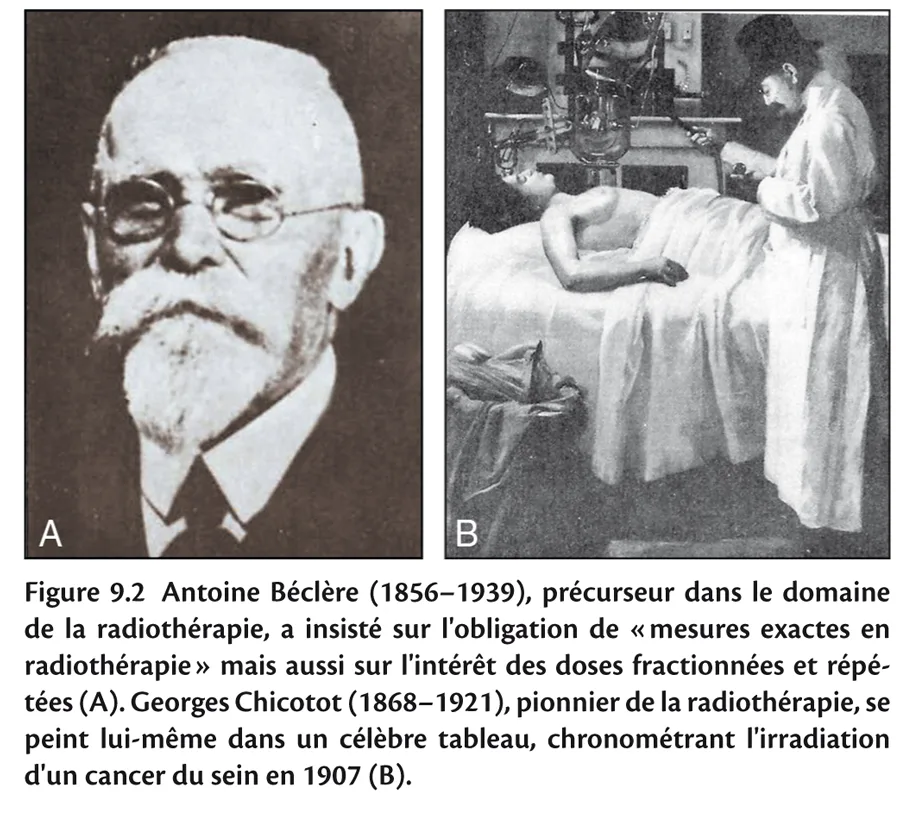
Fig 9.2
C’est pourquoi il faut, comme le publièrent les premiers utilisateurs (figure 9.2), soit s’en protéger, soit en contrôler l’exposition au moyen de mesures. La notion de dosimétrie est née.
1.5. Évolution des techniques de traitement
Durant les premières décennies, l’enjeu a été de produire des rayonnements plus énergétiques donc plus pénétrants et par conséquent offrant une meilleure tolérance.
Radiothérapie externe au radium Le fait que les rayons gamma du radium présentent l’avantage de pénétrer plus profondément dans les tissus que les rayons X de la radiologie, mais aussi, la nécessité de disposer de champs de traitement plus grands, ont fait naître l’idée de créer des appareils chargés de plusieurs sources placées à distance de la peau : ils sont appelés « bombes au radium ». Ainsi, peu avant la Seconde Guerre mondiale, la Fondation Curie s’équipe d’appareils chargés de 5 à 10 grammes de radium.
Radiothérapie dite conventionnelle De son côté, l’industrie radiologique tente de développer des tubes à rayons X dits de « supravoltages » afin de produire des rayonnements plus énergétiques. Mais l’accélération des électrons dans un tube sous le seul effet de la différence de potentiel présente des limites technologiques. Des générateurs de 200 kV sont utilisés mais les rayons produits, trop vite atténués dans la matière, sont responsables d’effets secondaires au niveau cutané qui sont restés dans les mémoires.
Accélérateurs de particules En 1930, le physicien américain Ernest Orlando Lawrence invente le premier cyclotron : il conçoit une technique pour produire des particules de très haute énergie sans utiliser une forte tension électrique. Cette invention est déterminante pour la radiothérapie moderne, celle utilisant des rayonnements de haute énergie ou «mégavoltages».
Télécobalthérapie Les années 1950 voient naître au Canada la série des « Theratron » (figure 9.3), appareils contenant les premières sources de cobalt 60, radioactives, obtenues dans un réacteur à partir du cobalt 59 naturel.
Ils sont plus performants à plusieurs titres: l’activité des sources est plus forte, l’énergie des rayons γ est plus élevée, la distance entre la source et la peau augmente, ce qui permet des champs adaptés aux besoins cliniques; les appareils sont rotatifs et permettent «les faisceaux croisés», et les premiers modificateurs de faisceaux peuvent être placés entre la source et la peau du patient.
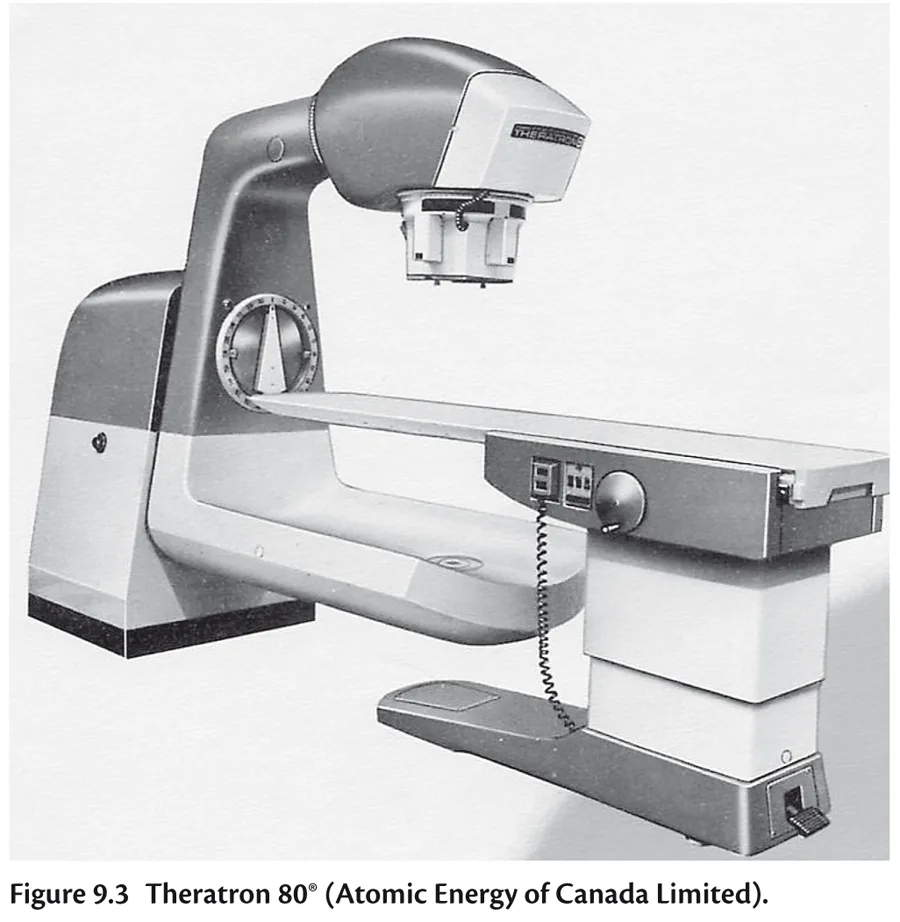
Fig 9.3
Nouvelle génération d’accélérateurs Depuis les années 1970, la prise en compte des limites de la télécobalthérapie et la volonté d’optimiser les traitements en matière d’énergie et de radioprotection ont progressivement fait s’imposer les accélérateurs linéaires mais au prix de progrès décisifs qu’il a fallu maîtriser dans différents domaines (figure 9.4):
en physique des particules, pour les modalités d’accélérations performantes
en technologie et géométrie des appareils, autorisant les techniques isocentriques en modulation d’intensité couplées aux techniques d’imagerie modernes
en électronique et en informatique, afin de sécuriser les programmations.

Fig 9.4
2. Définitions
La radiothérapie est une spécialité depuis toujours associée à l’imagerie médicale: d’abord parce qu’elle est historiquement une composante du grand domaine de l’électroradiologie médicale, ensuite parce qu’elle fait partie du domaine d’activité du manipulateur.
Ce regroupement paraît assez logique puisqu’il est lié à l’utilisation d’agents physiques et notamment les radiations ionisantes; en revanche les indications des deux spécialités sont à l’origine distinctes puisqu’il s’agit, pour l’imagerie médicale de moyens de diagnostic, et pour la radiothérapie de moyens thérapeutiques. Néanmoins, les frontières s’estompent car l’évolution a conduit l’imagerie médicale vers des activités thérapeutiques et la radiothérapie vers des activités d’imagerie pour notamment la définition des volumes, la définition des plans de traitements, les centrages et les contrôles.
Il est indispensable que, dans son champ de compétences, le manipulateur maîtrise cette discipline, tant du point de vue des rayonnements utilisés que des techniques d’application.
2.1. Définition de la radiothérapie
La radiothérapie est généralement définie comme la spécialité médicale utilisant les radiations ionisantes en tant qu’agent de traitement avec l’objectif de guérir ou de soulager les malades en bloquant la capacité des cellules cancéreuses à se multiplier.
On peut distinguer la radiothérapie fonctionnelle ou antiinflammatoire, aujourd’hui très limitée, de la radiothérapie anticancéreuse; en effet, si la radiothérapie à ses débuts était empirique, avec de multiples indications, elle est devenue une vraie spécialité qui tient une place incontestable dans le traitement des cancers. Elle est aujourd’hui un moyen de traitement performant à côté de la chirurgie ou de la chimiothérapie, du fait de la bonne maîtrise des rayonnements et des techniques utilisés.
Les traitements prescrits par le médecin spécialiste (oncologue radiothérapeute) sont réalisés par les manipulateurs en électroradiologie médicale comme le précise le décret no 97-1057 d’actes et d’exercice du Code de la santé publique.
2.2. Caractéristiques des radiations ionisantes utilisées
Qualité La qualité des rayonnements est liée à leur nature (leur substance) d’abord, puis à leur énergie (leur capacité à provoquer des ruptures de liaisons physico-chimiques).
La nature ou l’énergie des rayonnements va conditionner leur pouvoir de pénétration, notion primordiale dans la prescription d’un traitement.
Du point de vue de la nature des rayonnements, la radiothérapie peut faire appel à des rayonnements de particules (électrons, protons) ou à des ondes électromagnétiques constituées de photons de haute énergie (rayons X: RX; rayons gamma: Rγ).
Les premiers sont des particules matérielles possédant une masse et une charge, les seconds sont sans masse et sans charge, leurs parcours dans la matière seront très distincts et leur pouvoir de pénétration très spécifique.
Selon l’énergie des rayonnements, il faut distinguer la «roentgenthérapie», ou radiothérapie conventionnelle pour les rayons X issus de générateurs dont la tension pouvait atteindre 250 kV (totalement abandonnée), et la radiothérapie moderne qui utilise des rayonnements d’énergies qui se situent entre 4 et 25 MeV, pour lesquels on parle de mégavoltages ou de «haute énergie».
Origine Du point de vue de l’origine des rayonnements, il faut distinguer ceux issus de la radioactivité de ceux produits par les générateurs et par les accélérateurs de particules. Cette distinction induit une gestion du matériel et des techniques d’applications adaptées.
Classification Un tableau récapitulatif permet de classer les rayonnements selon leur qualité et leur production (tableau 9.1).

Tab 9.1
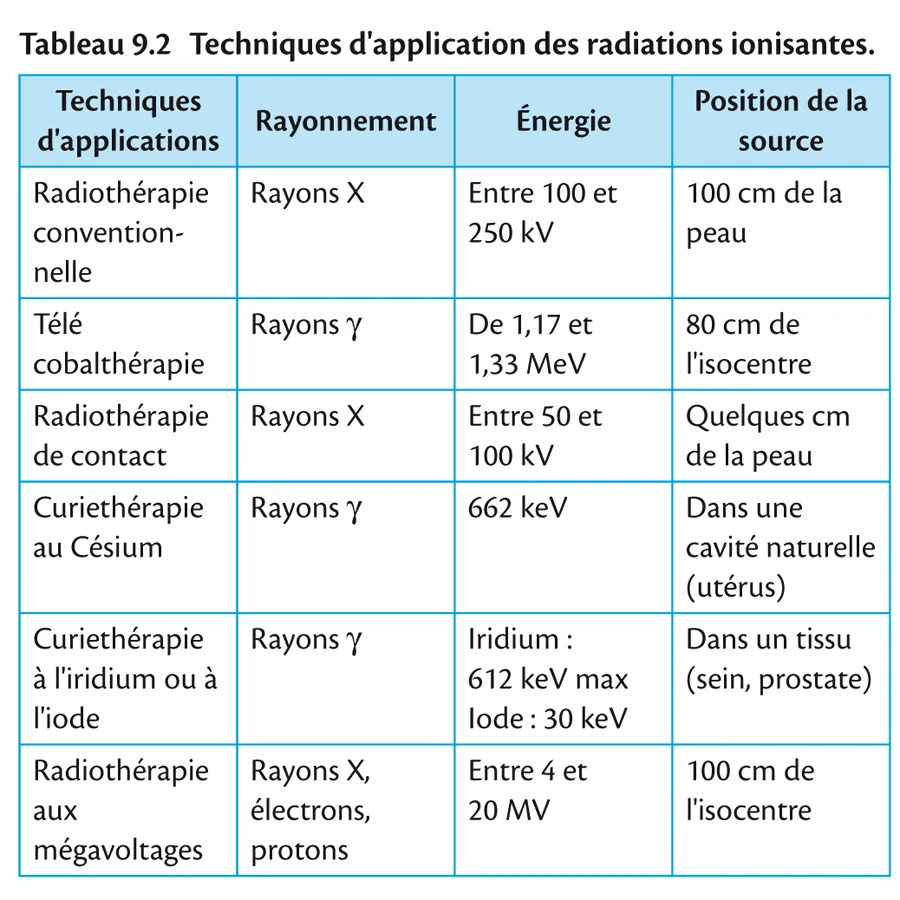
2.3. Techniques d’application
Radiothérapie externe La source de rayonnement est placée en dehors du malade. Elle peut être située à distance ou au contact du malade; dans les deux cas la radiothérapie est transcutanée. Le rayonnement peut être produit par une source radioactive comme le cobalt ou par un générateur ou un accélérateur de particules.
Curiethérapie La source de rayonnement est placée à l’intérieur de l’organisme du malade; les sources sont radioactives, sous forme scellée comme le césium, l’iridium ou l’iode.
Elles peuvent être placées dans une cavité, on parle alors de curiethérapie de contact ou plésiocuriethérapie, qui se décline en curiethérapie endocavitaire et curiethérapie endoluminale.
Tab 9.2
Elles peuvent être placées directement dans un organe, on parle alors de curiethérapie interstitielle ou endocuriethérapie.
Classification des techniques d’application On retrouve le résumé de ces techniques dans un tableau récapitulatif (tableau 9.2) en précisant que seules la curiethérapie à l’iridium ou à l’iode radioactifs et la radiothérapie externe aux mégavoltages restent d’actualité.
2.4. Indications
Spécialités médicales concernées Le domaine de la médecine appliquant les propriétés biologiques des radiations ionisantes se restreint essentiellement à celui de la cancérologie.
En effet, bien qu’ayant fait ses preuves, l’utilisation des radiations ionisantes est aujourd’hui controversée dans diverses spécialités comme la dermatologie ou la rhumatologie pour des raisons évidentes de radioprotection. C’est dans le domaine des malformations artérioveineuses ou de la neurologie que la radiothérapie des maladies non cancéreuses connaît un regain d’intérêt.
Objectifs de la radiothérapie anticancéreuse La radiothérapie associée ou non à la chirurgie, à la chimiothérapie ou à l’hormonothérapie s’inscrit parfaitement dans le schéma de pluridisciplinarité dans la prise en charge du malade atteint de cancer. Elle participe au contrôle de la maladie en permettant des gestes plus limités sur le plan chirurgical préservant ainsi l’esthétisme et le confort de vie du malade.
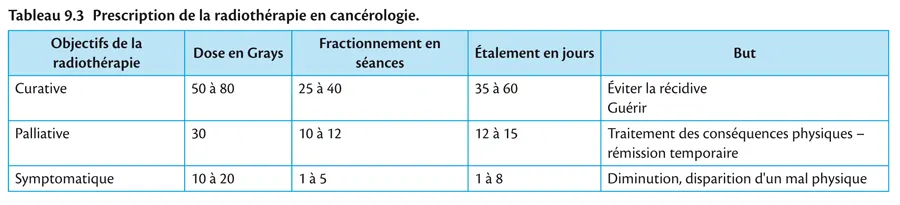
Près de 60 % des malades atteints de cancers bénéficient de la radiothérapie, selon des modalités adaptées au contexte de la maladie (tableau 9.3).
La radiothérapie est dite curative dès lors qu’elle est prescrite dans le but de guérir le malade. L’objectif est de stériliser sur le plan locorégional la colonie de cellules cancéreuses et de prévenir ainsi la récidive ou la dissémination. Le traitement sera long car il nécessite des doses élevées (entre 40 et 80 grays).
La radiothérapie palliative est prescrite dans le but de freiner l’évolution de la maladie et d’assurer au patient une rémission clinique dans le cas où les tumeurs sont trop évoluées ou dans les situations de dissémination métastatique. Le traitement sera court et la dose délivrée dans les limites de la tolérance (ex.: dix séances de 3 grays).
Tab 9.3
La radiothérapie symptomatique a pour but de soulager le patient d’un symptôme gênant, celui-ci pouvant survenir à un stade évolué mais parfois précoce de la maladie. La douleur est le symptôme le plus fréquent, mais il peut parfois s’agir de compression médullaire ou d’hémorragie. La radiothérapie est alors prescrite de façon concentrée sur une à cinq séances.
3. Réglementation
Les services de radiothérapie ont toujours été considérés comme étant des structures «lourdes» du point de vue des investissements, des installations et du fonctionnement, c’est pourquoi ils font l’objet d’autorisations et de contrôles stricts par les instances habilitées.
3.1 . Structures administratives
Un service de radiothérapie peut être installé dans des structures au statut administratif différent: elles diffèrent du point de vue des modes de gestion, de financement, d’organisation et de participation aux missions de service public.
Ainsi, on distingue en France: Les établissements publics: centres hospitaliers universitaires ou centres hospitaliers régionaux, sous la tutelle du ministère de la Santé, plus particulièrement de la Direction générale de l’offre de soins (DGOS) et, localement, de l’agence régionale de santé (ARS)
Pour en savoir plus
La loi du 21 juillet 2009 (loi HPST: Hôpital, Patient, Santé, Territoire) crée, dans son article 118, les agences régionales de santé. Elles sont le pilier de la réforme du système de santé. Pour mettre un terme au cloisonnement des compétences et des autorités publiques en matière d’administration de la santé en région, la loi HPST réunit les services de l’État et, pour partie, ceux de l’assurance maladie.
L’objectif de la loi est un rééquilibrage des installations, établissements de santé et équipements sanitaires afin de mieux répondre aux besoins des populations; elle s’inscrit dans une logique d’aménagement du territoire notamment par le biais du schéma régional d’organisation des soins (SROS).
Toute activité de soins listée par le Code de la santé publique fait l’objet d’une procédure d’autorisation préalable. C’est le directeur général de l’agence régionale de santé (ARS) qui a le pouvoir d’autorisation.
Les centres de lutte contre le cancer (CLCC): établissements privés à but non lucratif, participant au service public hospitalier, regroupés en fédération nationale chargée d’une mission globale (prévention, dépistage, soins, enseignement, recherche)
Pour en savoir plus
Ce sont, en France, des structures originales ayant pour but de coordonner la lutte contre le cancer à l’échelon régional, d’assurer les soins aux malades, de développer une recherche pluridisciplinaire et d’améliorer l’enseignement, la formation des professionnels de la santé et l’information du public. À ce titre, dans chaque région, les CLCC composent en général avec les centres hospitalo-universitaires (CHU) pour devenir les cancéropôles de référence.
Ils ont été créés à l’initiative du docteur Claudius Regaud puis du ministre de l’Hygiène, de l’Assistance et de la Prévoyance sociale, Paul Strauss qui, en 1922, a donné à tous les préfets des instructions pour que soit organisée sur tout le territoire la lutte contre le cancer ; mais il a fallu attendre le 1er octobre 1945 pour que soit promulguée l’ordonnance no 45-2221, acte officiel de la naissance des CLCC en France.
– les structures libérales : installées dans ou à proximité de cliniques, elles répondent aux mêmes obligations en matière de qualité des soins délivrés aux patients. Les établissements privés sont la propriété de particuliers ou de sociétés. Par ailleurs, la loi HPST innove en prévoyant la possibilité de confier aux établissements de santé privés une ou plusieurs missions de service public, cela dans le cadre d’un contrat signé entre le directeur général de l’ARS et l’établissement.
3.2. Équipements
Quel que soit leur statut, les services de radiothérapie sont équipés d’appareils qui relèvent de ce qu’on appelle des «équipements lourds».
Définition L’article L. 6122-14 du Code de la santé publique définit les équipements lourds comme « les équipements destinés à pourvoir soit au diagnostic soit à la thérapeutique ou à la rééducation fonctionnelle (…) et qui ne peuvent être utilisés que dans des conditions d’installation et de fonctionnement particulièrement onéreuses ou pouvant entraîner un excès d’actes médicaux ».
La création, l’extension, la transformation des installations et des équipements lourds font l’objet d’un suivi particulier par les SROS.
Indices de besoins La mise à niveau de la radiothérapie en France a constitué l’une des priorités stratégiques du plan cancer (2003–2007) au travers du renforcement des équipements et des moyens humains et de la revalorisation de la discipline. Le troisième plan cancer (2014–2019) poursuit ces objectifs en préconisant par exemple de:
garantir une offre adaptée en équipements de radiothérapie sur le territoire
organiser un maillage territorial adapté pour les équipements de haute technicité
L’analyse des besoins s’appuiera notamment sur
des indicateurs démographiques
: données du recensement, projections démographiques et perspectives d’évolution de la démographie des professionnels
des indicateurs épidémiologiques
: à partir des données des observatoires régionaux de la santé et des registres ainsi que des éléments statistiques disponibles au niveau national
des indicateurs géographiques
: déterminant l’accessibilité aux structures
À noter que le schéma de troisième génération s’inscrit dans « une optique nouvelle, fondée à la fois sur les principes de l’équité d’accès aux soins, de la coordination des acteurs et de la qualité des pratiques professionnelles » (Circulaire du 22 février 2005 relative à l’organisation des soins en cancérologie).
3.3. Dispositions et recommandations ministérielles
Activité L’activité, reconnue comme minimale par le ministère de la Santé dans l’arrêté du 29 mars 2007 est, pour la radiothérapie, de l’ordre de 600 patients par an et par site disposant de deux appareils au moins.
Équipements Dans tous les cas, le plateau technique doit permettre de dispenser des traitements diversifiés dans une gamme d’énergie comprise au moins entre 6 et 15 MV.
Ressources humaines Les centres de radiothérapie disposent d’une équipe, présente à temps plein, constituée au minimum par les professionnels de la santé suivants:
médecin spécialisé en oncologie et radiothérapie
personne spécialisée en radiophysique médicale, seule responsable de la dosimétrie clinique et de la qualité des rayonnements, du fonctionnement des divers appareils et de la sécurité du département d’irradiation
dosimétriste, placé sous la responsabilité du physicien en charge des études dosimétriques et de la préparation des plans de traitement
manipulateurs en électroradiologie médicale, en charge de mettre en œuvre les traitements, de contrôler et surveiller l’installation du patient, les paramètres du traitement, les images portales (deux par appareil de traitement et au moins un manipulateur au simulateur ou scanner dédié), parmi eux certains auront une expérience acquise en dosimétrie
Pluridisciplinarité Les équipes des centres de radiothérapie participent aux réunions de concertation pluridisciplinaire. L’intégration du service de radiothérapie dans un réseau de soins de cancérologie est un facteur de qualité des pratiques.
Pour la mise en œuvre des traitements, d’autres partenariats sont nécessaires comme l’accès aux appareils d’imagerie et les possibilités d’hospitalisation.
Accès à l’imagerie Les centres de radiothérapie doivent disposer d’un accès aux techniques d’imagerie indispensables à la préparation des traitements et à l’acquisition des données nécessaires à:
la définition anatomique et au centrage
la localisation des volumes cibles et des organes sensibles
la dosimétrie
Dossier patient en radiothérapie Le dossier de radiothérapie contient au minimum les éléments suivants: classification de la maladie, modalités de la décision thérapeutique, prescription du traitement, type de préparation des traitements, contrôles balistiques réalisés, enregistrement des séances, résultats de la dosimétrie in vivo et compte rendu de fin d’irradiation précisant les doses reçues.
Le traitement informatique des données et les possibilités de réseaux ont abouti au développement de fichiers enregistrés et consultables à différents postes.
Ce dossier s’intègre dans le dossier médical de cancérologie du patient qui est soumis aux obligations légales (Code de la santé publique: loi du 4 mars 2002 sur les droits du malade et la qualité du système de santé).
Qualité des soins La loi du 13 août 2004 a créé en France la Haute Autorité de santé (HAS) relative à l’assurance maladie dont la mission est de contribuer à assurer la qualité des soins délivrés aux patients par le biais d’évaluations, de recommandations et d’actions. Cette autorité publique indépendante s’applique à l’ensemble du système de santé et notamment aux nouvelles technologies de santé comme la radiothérapie (www.has-sante.fr).
Par ailleurs, les incidents et accidents survenus en radiothérapie sont à l’origine d’un renforcement des contrôles et des inspections par l’Autorité de sûreté nucléaire (ASN).
L’objectif de ces contrôles est de recenser les insuffisances en matière de ressources humaines ou d’organisation du travail et de notifier, aux centres visités, les critères à respecter pour assurer la qualité des traitements et la sécurité des malades (www.asn.fr).
En cancérologie, la radiothérapie est un traitement de référence. Les principes de son organisation ont permis le renforcement du parc des accélérateurs ainsi que la modernisation des centres. Ces mesures, couplées à une amélioration de l’organisation interne avec l’aide de la Mission nationale d’expertise et d’audit hospitalier (MEAH) contribuent à diminuer les délais d’attente entre la décision thérapeutique et la réalisation du traitement (depuis, la loi n°2009-879 du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires, la MEAH a intégré l’ANAP, Agence Nationale d’Appui à la Performance des établissements de santé).
En novembre 2007, le ministère de la Santé publie la feuille de route en radiothérapie suite à un travail collectif regroupant:
l’Institut national du cancer (INCa)
l’Autorité de sûreté nucléaire (ASN)
l’Agence française de sécurité sanitaire des produits de santé (Afssaps) devenue l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) selon la loi du 29 décembre 2011
l’Institut de veille sanitaire (InVS)
la Société française de radiothérapie oncologique (SFRO)
4. Organisation du service de radiothérapie
4.1. Plateau technique
Salles de traitement Il s’agit des locaux équipés des appareils de traitement et de tous les accessoires nécessaires (moyens de contention). Chaque salle est rattachée à un poste de commande et de contrôle, une salle d’attente, des cabines de déshabillage, installés à proximité.
L’architecture de ces salles intègre obligatoirement les mesures de radioprotection (portes blindées actionnées électriquement, chicane à l’entrée de la salle) pour la radioprotection des personnels, ainsi que les contraintes liées à la circulation des patients (lit d’hôpital, brancards, chaise roulante).
Unité de préparation des traitements Lieu d’acquisition des données (images) en vue de la dosimétrie et du traitement, ces salles dotées anciennement de simulateurs sont équipées aujourd’hui dans tous les centres de scanners dédiés.
La préparation des traitements comporte également des laboratoires pour la confection des protections plombées ou des moyens de contention personnalisés.
Unité de radiophysique L’unité de radiophysique est un espace équipé de postes informatiques installés en réseau avec les salles de préparation et de traitement.
Cet espace est réservé aux médecins prescrivant les volumes pour le traitement, aux radiophysiciens et techniciens chargés de la dosimétrie.
4.2. Organisation des soins
Le service de radiothérapie ne se limite pas au plateau technique (salle de traitement, scanner dédié, unité de radiophysique), il comporte un ensemble de structures destinées à l’accueil, à la prise en charge et au suivi des patients.
Accueil et secrétariat C’est l’espace incontournable qui constitue le pilier et le noyau central pour la communication entre le personnel soignant, les correspondants extérieurs, les patients, les familles, les transporteurs, les organismes de Sécurité sociale…
Unités de consultation Les bureaux de consultations médicales (et paramédicales), rattachés à des salles de soins polyvalentes pour le suivi médical et les examens cliniques, sont des lieux privilégiés dans la relation soignant–soigné pour:
informer le patient sur les modalités du (des) traitement(s)
le suivi et la surveillance régulière au cours du traitement
l’information du patient sur l’existence et les modalités d’accès des soins de support
discuter avec le patient de la nécessité de structures de soins qui peuvent être associées à la prise en charge de la maladie
Pour en savoir plus Les soins de support tels qu’ils sont définis dans la circulaire du plan cancer représentent l’ensemble des soins, à la fois techniques et psychosociaux, nécessaires aux personnes atteintes de maladies graves (www.e-cancer.fr/Patients-etproches/ Qualite-de-vie/Soins-de-support/Definition).
Ils ne constituent pas une nouvelle spécialité mais un réseau de différentes compétences proposées au patient pour améliorer sa qualité de vie pendant la maladie et les traitements. Les compétences relèvent de professionnels formés à la prise en charge de la douleur, aux soins palliatifs, à l’accompagnement, à la nutrition, aux soins esthétiques… L’objectif commun est la prise en charge plus «globale» du patient atteint d’un cancer.
Bibliographie des chapitres 9 à 14
Autorité de sûreté nucléaire (ASN) . La réglementation – Le guide « Inondations » – La dose au patient . mars 2014 . revue Contrôle no 197.
Galle P , Paulin R . Biophysique 1 . Radiobiologie, radiopathologie . Paris : Masson ; 1991 .
General Electric CGR Europe . Descriptif technique Saturne ; 1990 .
Guillet J P . Abrégé de physique radiothérapique – La téléthérapie . Sauramps Médical ; 1994 .
Institut de radioprotection et de sûreté nucléaire (IRSN) . Rapport, exposition professionnelle aux rayonnements ionisants en France : bilan ; 2013 .
Lartigau E . La radiothérapie oncologique : concepts, techniques et applications cliniques . Société française du cancer/John Libbey Eurotext ; 2009 .
Mazeron J J , Maugis A , Barret C , Mornex F . Techniques d’irradiation des Cancers . Paris : Maloine ; 2005 .
Michel-Langlet P , Raoul Y , Martin D . Oncologie radiothérapique . Paris : Masson ; 1996 .
Siemens Division Médicale . Les accélérateurs de particules linéaires, Mevatron, Primus . 2001 .
Les Auteurs
Jean-Philippe Dillenseger, Elisabeth Moerschel et Claudine Zorn sont enseignants en imagerie médicale et radiologie thérapeutique au lycée Jean-Rostand de Strasbourg.