Lymphoedèmes secondaires du membre supérieur après cancer du sein
16 mars 2016
Par Monique Remillieux
S. Alran, A. Arnaud, J.-C. Biffaud, J.-C. Ferrandez, P. Heudel
Plan du Chapitre I. Généralités 154 Historique et généralités 154 Étiologie et risques 154 Quelle définition du lymphoedème du membre supérieur ? 154
II. Rôle du système lymphatique dans la dissémination du cancer du sein 155 Système lymphatique 156 Dissémination du cancer 156 Dissémination par voie lymphatique 156

Plan du Chapitre
Rôle des facteurs lymphangiogéniques 156 Rôle des chimiokines 157
III. Effets de la radiothérapie sur le système lymphatique 158 Histopathologie 158 Aspect clinique : lymphoedème 159
IV. La chirurgie axillaire et mammaire dans le cancer du sein 160 La chirurgie axillaire dans le cancer du sein et son effet sur le système lymphatique 160 Chirurgie mammaire 162 Complications lymphatiques postopératoires 162 Complications à distance : le lymphoedème du membre supérieur 163 Effets des autres traitements sur le système lymphatique 164
Conclusion 165
I. Généralités
J.-C. Ferrandez
Historique et généralités
Les premières descriptions d’un lymphoedème apparaissant après cancer du sein ont suivi celles de la chirurgie. Halsted publiait en 1896 les étapes de la chirurgie radicale qui allait porter son nom et décrivait, dès 1925, leurs séquelles [1]. Les « gros bras » de cette époque étaient d’origine mixte veinolymphatique. L’évidement du creux axillaire jusqu’à la veine axillaire provoquant des cicatrices sténosantes de la veine diminuait le retour veineux en plus du déficit lymphatique du membre supérieur.
Les premières études concernant l’étiologie du lymphœdème secondaire ont mis l’accent sur la responsabilité partagée entre la chirurgie et la radiothérapie adjuvante.
Aujourd’hui, les choses ont changé : les techniques chirurgicales et radiothérapiques sont beaucoup moins agressives sur l’arbre lymphatique que par le passé. Cependant, l’incidence du lymphoedème reste élevée malgré une chirurgie moins invasive et le développement des techniques du « ganglion sentinelle ».
Étiologie et risques
L’anatomie du drainage de certains vaisseaux lymphatiques superficiels du membre supérieur converge inexorablement vers des noeuds communs au drainage du sein. Leur prélèvement pour évaluer leur statut d’envahissement éventuel porte toujours atteinte au drainage du membre supérieur. La fonction lymphatique du membre est perturbée comme en témoignent les lymphographies [2] et les lymphoscintigraphies [3]. Le lymphoedème n’apparaît pas si les phénomènes de compensation sont suffisants. Dans le cas contraire, l’oedème peut apparaître de façon variable. Son délai d’apparition par rapport à l’opération et à sa localisation varie.
Le risque de lymphoedème a été apprécié par une étude réalisant une méta-analyse portant sur 70 études dont 30 prospectives [4]. Une femme sur cinq développe un lymphoedème. Un grand nombre de noeuds prélevés expose à un risque plus important de lymphoedème, tout comme le surpoids et l’obésité. La technique du ganglion sentinelle limite ce risque à 5 %. Parmi les facteurs supposés aléatoires, la notion de capital lymphatique préexistant et l’existence de voies anatomiques spécifiques ont été alléguées pour expliquer l’apparition ou non du lymphœdème. Intuitivement, cette notion de capital lymphatique avait été très tôt mise en avant sans être bien démontrée. La terminaison individuelle des voies lymphatiques dans le creux axillaire de la patiente est variable, aboutissant vers des noeuds situés plus ou moins haut. Récemment, un facteur individuel a été découvert. La présence d’un gène prédisposant semble augmenter ce risque [5].
Indépendamment de ces facteurs, le développement d’épisodes infectieux aggrave aussi le dysfonctionnement lymphatique. La propagation de germes dans la lumière des vaisseaux participe, par les dépôts que ceux-ci y laissent, à la diminution de la fonction lymphatique en réalisant des lymphangiothromboses.
Quelle définition du lymphoedème du membre supérieur ?
La définition physiopathologique du lymphoedème se fonde sur l’existence d’une infiltration du membre par un liquide à forte teneur en protéines même si, pour certains auteurs, ce serait plus la concentration en acide hyaluronique qui serait concernée. En revanche, la définition clinique consensuelle est plus variable.
L’augmentation du volume signe le lymphoedème, mais la mesure périmétrique différentielle ne prend pas en considération que l’oedème. La dominance du membre entre en jeu jusqu’à un certain point. La marge d’erreur de la mesure est aussi à considérer. Ainsi, il est admis qu’une différence de 2 cm entre les deux membres témoigne d’un lymphœdème [6].
La différence de volume est parfois retenue pour affirmer le diagnostic. Un différentiel de 200 ml est une marge classique. De façon plus personnalisée, certains auteurs retiennent une différence de 10 % de volume entre les deux membres.
Une autre manière de poser le diagnostic est de s’en référer à la gêne ressentie par la patiente. La lourdeur, la pesanteur, la sensation d’engoncement sont des signes subjectifs associés aux premiers stades du lymphoedème.
Le délai d’apparition est variable et imprévisible. Il n’est pas possible d’affirmer à une patiente que, passé un certain délai de la chirurgie, son risque de lymphoedème a disparu.
L’étude d’Armer [7], qui a suivi près de 200 patientes jusqu’à 5 ans, a mis en évidence que les lymphoedèmes apparaissent jusqu’à cette date, impliquant que le risque cumulé à 5 ans est de l’ordre de 50 %. Dans un autre travail, le délai d’apparition du lymphoedème est en moyenne de 12 mois alors que les patientes ne consulteront pour ce motif qu’à 18 mois, signifiant que sa progression est insidieuse avant de gêner la patiente et déclencher la consultation [8].
La localisation du lymphoedème secondaire semble particulièrement aléatoire. Toutes les formes cliniques sont rencontrées : lymphoedème atteignant quelques doigts seulement ou la main dans son ensemble, avant-bras concerné associant plus ou moins la main, bras œdématié isolé, membre dans son entier, infiltration du quadrant opéré. Cette localisation n’est pas le fruit du hasard, mais est bien en relation avec l’atteinte de certaines voies et l’ablation de certains lymphonoeuds. Chaque noeud recevant plus particulièrement le compartiment liquidien d’un territoire anatomique spécifique (lymphotome), l’infiltration peut concerner une zone différente.
Classiquement, le kinésithérapeute retiendra l’existence de trois formes principales :
Oedème proximal (suspendu) ;
Oedème distal (avant-bras ± main) ;
Oedème complet (± main).
Les formes infiltrant la racine peuvent accompagner les deux premières d’un oedème du quadrant (sein ou thorax).
Chaque localisation fait l’objet d’une prise en charge spécifique.
II. Rôle du système lymphatique dans la dissémination du cancer du sein
P. Heudel
Le cancer du sein est un problème de santé publique représentant le premier cancer féminin en France en termes d’incidence, avec plus de 50 000 nouveaux cas par an, comme en termes de mortalité, avec plus de 10 000 décès par an [1, 2]. Malgré ces chiffres qui restent élevés, la mortalité du cancer du sein diminue sensiblement en rapport avec des progrès diagnostiques e thérapeutiques. Grâce notamment au dépistage systématique, le diagnostic du cancer du sein se fait le plus souvent à un stade localisé. Cependant, l’envahissement carcinomateux ganglionnaire axillaire est le site métastatique le plus précocement et le plus fréquemment atteint. Touchant environ 40 % des patientes ayant un cancer du sein invasif, il témoigne d’une dissémination des cellules cancéreuses [3, 4]. Bien que le processus de carcinogenèse reste incertain et implique de nombreux processus différents, il apparaît évident que le système lymphatique joue un rôle important dans la dissémination métastatique du cancer du sein [5]. Ce système lymphatique comprend un vaste réseau composé de capillaires, ganglions et vaisseaux lymphatiques jouant un rôle majeur dans le système immunitaire, mais il est également impliqué dans le transport de déchets, des lipides, etc.
Système lymphatique
Le système lymphatique est composé de vaisseaux qui drainent les liquides interstitiels de l’organisme vers des organes lymphoïdes comme les ganglions lymphatiques, la rate et les amygdales. La circulation de la lymphe à l’intérieur des voies lymphatiques est unidirectionnelle, des tissus vers les ganglions lymphatiques, puis vers le réseau veineux. Le débit de la lymphe est très faible, estimé à environ 1 litre par 24 heures. Des valvules tronconiques servent de système antiretour. Chez l’homme, il existe environ 800 ganglions répartis dans environ 300 sites [6]. Ce réseau permet une régulation permanente du niveau d’hydratation tissulaire ainsi qu’une évacuation de certains déchets cellulaires.
En effet, l’endothélium capillaire n’étant pas parfaitement imperméable aux protéines, notamment de petite taille (< 50 kD), l’absence de système de drainage engendrerait une accumulation de protéines dans le milieu extracellulaire et ainsi un oedème oncotique.
D’un point de vue immunitaire, les vaisseaux lymphatiques transportent également des globules blancs, des antigènes et des cellules présentatrices d’antigènes. C’est la mise en relation entre les lymphocytes naïfs et les cellules présentatrices d’antigènes dans le système lymphatique qui engendre l’activation des défenses de l’organisme. En effet, à la sortie des organes lymphoïdes primaires, les lymphocytes B et T sont devenus immunocompétents mais ne sont pas encore actifs. Ils migrent alors vers les organes lymphoïdes secondaires, lieu de la rencontre entre antigènes et lymphocytes immunocompétents [7].
Dissémination du cancer
La dissémination métastatique est une succession de processus biologiques différents et complexes rendant possible la migration de cellules tumorales de la tumeur initiale vers une localisation à distance, engendrant ainsi des métastases. Les cellules tumorales circulantes ont un rôle primordial dans cette évolution tumorale. Plusieurs hypothèses physiopathologiques existent pour expliquer le développement des métastases. Une métastase cancéreuse représente le développement d’autres foyers tumoraux, à distance du foyer initial. La dissémination cancéreuse succède à la phase locale, au cours de laquelle les cellules cancéreuses arrivent au contact des vaisseaux, traversent leurs parois et circulent dans le sang ou dans la lymphe [8]. Les voies lymphatiques, hématogènes et séreuses sont alors les voies de dissémination principales du cancer ; c’est la théorie « mécanique » [9].
Il y a plus d’un siècle, à partir de l’analyse des autopsies de 735 cas de cancer du sein, Stephen Paget soumet une autre hypothèse sur les mécanismes de dissémination du cancer ; c’est l’hypothèse « seed and soil ». Sa conclusion est que la distribution des métastases dans l’organisme n’est pas l’oeuvre du hasard et il pense que celle-ci est due « à la dépendance de la graine (la cellule cancéreuse) par rapport au sol (l’organe touché par la métastase) » [10].
Bien que cette hypothèse soit de vision très simpliste, les avancées scientifiques et les différentes interprétations de celle-ci font qu’elle reste encore évoquée actuellement par l’intermédiaire d’autres hypothèses beaucoup plus élaborées.
Dissémination par voie lymphatique
Le système lymphatique représente la voie principale de dissémination des cellules tumorales. Ces cellules sont entraînées vers les groupes ganglionnaires voisins du territoire dans lequel le cancer se développe de relais en relais. Le premier relais ganglionnaire du drainage lymphatique est appelé « ganglion sentinelle ».
Il existe plusieurs raisons expliquant l’implication du système lymphatique dans cette dissémination, mais le paramètre le plus important est l’immense étendue du réseau lymphatique qui draine absolument tous les territoires tissulaires. Le second élément réside dans la structure même des capillaires lymphatiques [11]. Ces microvaisseaux possèdent un endothélium extrêmement fin, formé d’une couche unique de cellules aplaties bordée par une membrane basale interrompue voire inexistante. Ces caractéristiques physiques sont des éléments essentiels mais insuffisants. En effet, il est désormais prouvé que d’autres facteurs sont nécessaires, comme la présence de facteurs de croissance ou de protéines ayant un rôle d’attraction sur les cellules tumorales.
Rôle des facteurs lymphangiogéniques
La lymphangiogenèse est un processus important durant le développement embryonnaire, mais n’existe pratiquement pas dans des conditions physiologiques normales postnatales.
Plusieurs études ont montré qu’il existait une sécrétion importante de facteurs de croissance lymphangiogéniques par la tumeur elle-même et par le micro-environnement péritumoral [12, 13]. Ces facteurs sont responsables de la formation de nouveaux vaisseaux lymphatiques au sein et autour de la tumeur, majorant le risque de dissémination métastatique [14].
Les différentes isoformes du vascular endothelial growth factor (VEGF) (A, B, C et D), le placenta growth factor (PIGF) et leurs différents récepteurs présents sur l’endothélium lymphatique, appelés vascular endothelial growth factor receptors (VEGF-R1, -R2, -R3), sont les principaux acteurs de la lymphangiogenèse.
Dans le cas du cancer du sein, il a été montré que l’hyperexpression du VEGF-C et du VEGF-D va stimuler la lymphangiogenèse par l’activation des récepteurs VEGF-R2 et -R3, provoquant la prolifération, la migration et la survie des cellules endothéliales lymphatiques [15, 16]. Il existe de nombreuses publications ayant démontré une corrélation significative entre des taux élevés de VEGF-C et de VEGF-D, le risque d’envahissement métastatique ganglionnaire et la survie globale des patientes [17, 18]. De nombreuses autres molécules participent à la lymphangiogenèse, comme les angiopoïétines-1 et -2 et leurs récepteurs Tie-1 et Tie-2, qui contrôlent la perméabilité et la survie des cellules endothéliales [19].
Rôle des chimiokines
Les chimiokines sont des petits polypeptides qui contrôlent l’adhésion et la migration des cellules du système immunitaire porteuses de certains récepteurs membranaires. L’interaction entre les chimiokines et ces récepteurs membranaires engendre une migration cellulaire directionnelle. L’expression de certaines chimiokines spécifiques a été retrouvée de manière plus importante dans certains organes qui sont le siège préférentiel des métastases. Ainsi, la présence de ces chimiokines dans ces organes va promouvoir la migration et l’adhésion de cellules tumorales exprimant le récepteur correspondant à la chimiokine.
Dans la dissémination métastatique du cancer du sein, l’interaction serait exclusive entre CXCL12, qui est la chimiokine qui joue un rôle important, et CXCR4, son récepteur correspondant Absent du tissu mammaire sain, ce récepteur membranaire est surexprimé dans le cancer du sein, avec un mécanisme qui reste mal défini [20]. De fortes concentrations de CXCL12 sont retrouvées au niveau des ganglions lymphatiques, induisant un gradient de concentration dans les vaisseaux lymphatiques. Ce gradient de concentration entraîne une attraction des cellules tumorales porteuses du récepteur CXCR4, favorisant ainsi le développement de métastases au niveau des ganglions [21]. En outre, d’autres données suggèrent que CXCL12 joue un rôle dans la dissémination de métastases dans des organes plus éloignés, car des concentrations élevées ont été retrouvées également au niveau pulmonaire, hépatique, osseux et cérébral, qui sont aussi des sites métastatiques préférentiels du cancer du sein [22, 23] (figure 25.1).
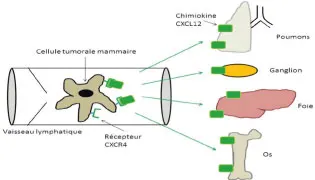
Fig25.1-2
Le système lymphatique et la lymphangiogenèse sont impliqués dans la dissémination métastatique du cancer. Cette implication passe par l’intermédiaire de l’intravasation des cellules tumorales dans les canaux lymphatiques permise par la sécrétion de facteurs de croissance ou de chimiokines au sein du système lymphatique. Les mécanismes qui gouvernent le passage de cellule tumorales au sein des vaisseaux lymphatiques, de même que ceux qui permettent la colonisation de tissus à distance demandent encore à être précisés, mais ils pourraient fournir des cibles pou le développement de stratégies thérapeutiques permettant de s’opposer à la dissémination métastatique.
La pratique du drainage manuel en cas de maladie évolutive n’est pas contre-indiquée, pas plus que l’activité physique qui augmente physiologiquement les phénomènes de résorption et d’évacuation lymphatique.
III. Effets de la radiothérapie sur le système lymphatique
A. Arnaud
La radiothérapie est impliquée dans le traitement d’environ 60 % des patients atteints de cancer. Son principe d’action est l’utilisation des rayonnements ionisants à visée thérapeutique. Son objectif va être de délivrer le maximum de dose à la tumeur (assurer le contrôle local) tout en épargnant au maximum les organes à risque à proximité. L’irradiation est responsable de morts cellulaires qui vont avoir des conséquences directes sur les tissus sains correspondant aux effets secondaires [1, 2].
Histopathologie
Les effets des radiations ionisantes sur ce système lymphatique vont être assimilés aux principaux effets obtenus sur l’endothélium vasculaire, à savoir la mort cellulaire radioinduite, l’activation du système de coagulation, l’activation endothéliale et la sécrétion de cytokines ou de facteurs de croissance (figure 25.2) [3].
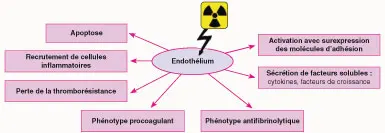
Fig25.2
Mort cellulaire radio-induite
Les cellules endothéliales sont considérées comme radiosensibles, ce qui explique cette mort cellulaire après irradiation, intervenant sous deux formes : « mort mitotique » (survenant au moment de la mitose) et « mort apoptique » (en dehors de toute mitose) [4]. Cette mort cellulaire contribue à l’initiation et à la progression des dommages radio-induits.
Activation du système de coagulation
Il s’agit d’un processus physiologique stimulé après irradiation correspondant à une perte de la thromborésistance endothéliale [3]. C’est en relation avec une sécrétion accrue de thrombine ayant une double action :
« Procoagulant » : à terme, cela va être responsable d’occlusions thrombotiques capillaires et d’athérosclérose accélérée ;
Augmentation de la synthèse de matrice extracellulaire (activation des fibroblastes) qui va conduire progressivement à l’apparition d’une fibrose périvasculaire [3].
Activation endothéliale
L’activation de l’endothélium vasculaire après irradiation se traduit par une augmentation de l’expression des protéines d’adhésion, qui participent au recrutement des cellules circulantes, responsables de l’inflammation radio-induite des tissus.
Sécrétion de cytokines ou de facteurs de croissance
Après irradiation, l’intima des vaisseaux va sécréter des facteurs de croissance dérivés des plaquettes, de type PDGF (platelet-derived growth factor), responsable d’une prolifération des cellules musculaires lisses à l’intérieur des capillaires de petit calibre, ce qui, à terme, participe au développement de la fibrose postradique.
Le FGF (fibroblast growth factor) sécrété après irradiation participerait à la prolifération anormale de cellules endothéliales, oblitérant la lumière des capillaires [5]. Le TGF-ß (transforming growth factor) activerait les gènes responsables de la production de collagène au niveau des fibroblastes périvasculaires, participant à la fibrose radio-induite [4].
Pour conclure sur le versant histopathologique, les phases précoces des lésions radio-induites sur le système lymphatique se caractérisent par une réaction inflammatoire importante en relation avec l’altération aiguë de l’endothélium vasculaire.
En ce qui concerne les dommages radio-induits tardifs, ils sont expliqués par l’apparition d’une fibrose périvasculaire en relation avec une accumulation pathologique de matrice extracellulaire, et particulièrement de collagènes fibrillaires.
Aspect clinique : lymphoedème
Nous prendrons comme exemple ici le lymphœdème du membre supérieur dans le cadre de la prise en charge thérapeutique d’une néoplasie mammaire. Il s’agit d’un lymphoedème « secondaire » en relation avec des vaisseaux lymphatiques endommagés responsables d’une déficience du drainage lymphatique sus-jacent par blocage mécanique.
Cette complication reste très souvent secondaire de l’association chirurgie (curage axillaire) et radiothérapie (des aires ganglionnaires axillaires principalement).
L’apparition d’un lymphoedème s’explique aisément par les différents phénomènes histopathologiques radio- induits précédemment décrits. Dans les suites immédiates du traitement du cancer du sein, l’oedème est essentiellement de surcharge, de type inflammatoire souvent réversible après quelques semaines [6].
Le véritable lymphoedème est tardif (en moyenne 12 mois après le traitement), en relation avec la fibrose radio-induite périlymphatique responsable d’une déficience du drainage lymphatique [6].
Néanmoins, cette complication est de moins en moins fréquente du fait d’une meilleure connaissance des facteurs de risque, d’une meilleure prise en charge préventive et curative (kinésithérapie), d’une amélioration des techniques de prélèvement ganglionnaire (technique du ganglion sentinelle) et d’une décroissance très significative des indications d’irradiation axillaire ainsi que d’une sophistication des traitements.
IV. La chirurgie axillaire et mammaire dans le cancer du sein
S. Alran, J.-C. Biffaud
La chirurgie axillaire dans le cancer du sein et son effet sur le système lymphatique
La chirurgie axillaire, étape quasi incontournable dans le traitement du cancer du sein, a un impact sur le système lymphatique. Elle interrompt les canaux lymphatiques et engendre des complications postopératoires immédiates, telles les lymphocèles et les brides lymphatiques, et plus tardives, tels les lymphœdèmes du membre supérieur.
Le ganglion sentinelle a marqué l’histoire de la chirurgie du cancer du sein. Cette évolution chirurgicale a eu un impact direct pour nos patientes en divisant par trois la morbidité engendrée par le curage axillaire (lymphœdème, douleur).
L’éducation des patientes dès la période postopératoire immédiate permet de diminuer les symptômes en rapport avec un lymphœdème [1].
L’objectif de cette section est de mieux comprendre la chirurgie du cancer du sein, en particulier la chirurgie axillaire, pour espérer intervenir précocement afin de diminuer les séquelles du membre supérieur des patientes qui auront un curage axillaire.
Relation entre l’anatomie lymphatique du sein et du membre supérieur
Les drainages lymphatiques anatomiques Le drainage mammaire est constitué d’un réseau glandulaire profond dont tous les éléments convergent vers le cercle périaréolaire de Sappey [2]. De ce cercle péri-aréolaire partent deux canaux collecteurs principaux et deux collecteurs accessoires qui se dirigent vers l’aisselle, en particulier vers le groupe thoracique antérolatéral, au contact de la face interne du creux axillaire. Cette distribution lymphatique, décrite à la fin du XIXe siècle, peut être mise en évidence in vivo par des colorants lymphotropes et/ou des isotopes (dans l’identification du ganglion sentinelle par exemple). Il existe encore, partant du cercle péri-aréolaire, deux voies lymphatiques accessoires qui vont directement, l’une vers la chaîne mammaire interne, l’autre vers les ganglions sous-claviculaires.
Convergence des ganglions lymphatiques du sein vers deux groupes essentiels Les ganglions axillaires sont divisés par les anatomistes en cinq groupes. Cependant, ces groupes ne sont pas strictement individualisés cliniquement dans l’aisselle et constituent un continuum relié par de multiples vaisseaux difficiles à systématiser. Berg, anatomopathologiste, avait décrit en 1955 [3] trois étages ganglionnaires, les niveaux I et II étant situés en dessous de la veine axillaire, et le niveau III au-dessus.
Les ganglions mammaires internes sont situés au niveau des trois premiers espaces intercostaux en arrière des cartilages costaux et des muscles intercostaux et en avant de la plèvre. Les ganglions axillaires et mammaires internes se jettent dans des ganglions de second niveau sus-claviculaires. Il existe, parfois, un drainage direct du sein vers les ganglions sus-claviculaires. Entre les grand et petit pectoraux, se trouve l’espace interpectoral, siège des ganglions de Rotter. Ceux-ci sont répartis le long des branches pectorales, des vaisseaux thoraco-acromiaux ; leur nombre varie entre 1 et 12 [4]. Il ne s’agit pas d’une structure constante [5, 6].
Chirurgie du sein et du creux axillaire en cancérologie
Curage axillaire Le curage axillaire consiste à retirer les ganglions situés sous la veine axillaire. La moyenne de ganglions retirés lors d’un curage axillaire est de 10 (figure 25.3). Le creux axillaire est une cavité virtuelle. L’abord chirurgical du creux axillaire nécessite une cicatrice cutanée puis l’ouverture de l’aponévrose axillo-clavi-pectorale, et la dissection des trois repères anatomiques : la veine axillaire en supérieur, le pédicule dentelé en médial et le pédicule du grand dorsal en latéral. Les ganglions axillaires sont inclus dans cet espace traversé par des nerfs sensitifs (2e et 3e nerfs intercostaux).
Fig25.3
La lésion de ces nerfs est à l’origine des douleurs neuropathiques de la face médiale du bras. Les techniques de lymphostase sont variables selon les chirurgiens : coagulation, clips, stripping lymphatique sans lymphostase. Dans la majorité des cas, il est réalisé une suture cutanée (surjet unique de fils résorbables). Un drain aspiratif peut être laissé dans l’espace opéré.
Ganglion sentinelle L’exérèse du ganglion sentinelle (GS) consiste à retirer le premier relais ganglionnaire : un à plusieurs ganglions identifiés de visu par un colorant bleu (bleu patenté) et/ou à la sonde de détection radio-isotopique grâce au traceur radioactif (technetium 99m) (figures 25.4 et 25.5). Ces traceurs sont injectés en périaréolaire avant l’intervention (10 minutes pour le bleu patenté et 45 minutes à 18 heures pour le technetium 99m). Cette technique est réservée aux tumeurs de taille généralement < 3 cm.
Dans la technique du GS, l’abord chirurgical est identique au curage axillaire ; les cicatrices sont plus courtes. La moyenne de GS prélevée est de deux (figure 25.6). Il n’y a pas de drainage.
Figure 25.4 Repérage à la sonde de détection de radioactivité.
Fig25.4
Figure 25.5 Repérage du ganglion sentinelle bleu et de son canal lymphatique et exérèse.
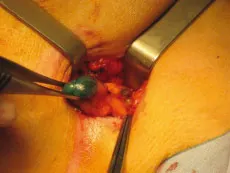
Fig25.5
Figure 25.6 Deux ganglions sentinelles prélevés
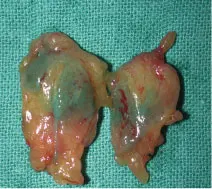
Figure 25.6
Adénectomie L’adénectomie est l’exérèse de(s) ganglion(s) à visée diagnostique dans le cadre du bilan de lymphome. La procédure chirurgicale est identique à celle du GS.
Chirurgie mammaire
Traitement conservateur
Le traitement conservateur consiste à retirer la tumeur avec une marge de sécurité suffisante en préservant le volume et la forme du sein. Dans certains cas (rapport taille tumorale/taille du sein quel que soit le quadrant du sein, localisation dans les quadrants inférieurs, internes), une technique oncoplastique est nécessaire pour prévenir une déformation mammaire. Ces techniques nécessitent une résection cutanéoglandulaire au large de la tumeur avec un repositionnement aréolaire après désépidermisation ; un geste de symétrisation controlatéral peut être proposé en cas d’asymétrie de volume (ce geste est réalisé généralement dans un deuxième temps à l’issue des traitements).
Traitement radical Ce traitement consiste à retirer la totalité de la glande mammaire en préservant les muscles grand et petit pectoraux. Ce traitement est indiqué en cas d’impossibilité de traitement conservateur ou à la demande de la patiente.
Reconstructions mammaires Les reconstructions mammaires sont proposées aux patientes ayant eu une mastectomie et se font secondairement, 6 à 12 mois après la fin de la radiothérapie de la paroi thoracique en cas de cancer infiltrant. Les types de reconstruction (prothèses rétromusculaires ou lambeaux musculaires dorsal ou grand droit) sont décidés par le chirurgien-plasticien après examen des patientes (état cutané après radiothérapie, notion de tabagisme, laxité cutanée, activité physique des patientes). Les reconstructions mammaires dans le même temps opératoire que la mastectomie, appelées encore reconstructions mammaires immédiates, ont des indications spécifiques : les cancers in situ étendus au sein ou localisées mais non accessibles à un traitement conservateur, les cancers infiltrants de petite taille et localisés dans les quadrants externes, et les récidives de cancer sous la forme in situ ou infiltrante (car il n’y aura pas d’indication à une irradiation en postopératoire).
Complications lymphatiques postopératoires
Lymphocèle
C’est une collection lymphatique qui se localise dans l’espace opéré (creux axillaire, loge de mastectomie ou de tumorectomie). Sa fréquence d’apparition en postopératoire est relativement fréquente, de l’ordre de 20 à 40 % [7, 8] et majorée en cas de mastectomie. Cela entraîne une gêne pour la patiente et peut nécessiter une à plusieurs ponctions évacuations pour soulager les symptômes. Les facteurs de risque identifiés sont le surpoids, la taille tumorale > 2 cm, le nombre de ganglions métastatiques, la durée du drainage [7].
Les traitements préventifs sont les suivants.
Le ganglion sentinelle à la place du curage axillaire a été le progrès majeur en chirurgie axillaire de ces dix dernières années. C’est actuellement le standard chirurgical en cas de cancer du sein infiltrant unifocal, Cette technique a permis de réduire d’un facteur 4 le risque de lymphocèle [9].
Le drainage. Le drain de Redon ou Jost-Redon a été mis au point par un chirurgien français, Henri Redon, et son interne Jost en 1954. Il s’agit d’un tube de matière souple percé de nombreux trous placé à l’intérieur de la cavité après une intervention chirurgicale. L’autre extrémité est reliée à un dispositif qui permet d’aspirer le contenu de la cavité (sang, liquide séreux, lymphatique). Différentes études ont comparé les modalités de prise en charge postopératoire après un curage axillaire : (1) le drainage et sa durée [10–12] (2) l’absence de drainage [13] ; (3) le capitonnage [9]. Les drainages de courte durée et le capitonnage sont des alternatives au drainage de longue durée. L’avantage des deux premières méthodes est un raccourcissement des durées d’hospitalisation. Le taux d’apparition de lymphocèle est équivalent dans les trois cas de figure. L’avantage du drainage prolongé est la diminution des lymphocèles chez les patientes qui ont un curage et une mastectomie.
Les types d’énergie utilisés en chirurgie (bipolaire, ultracision ou colles chirurgicales) n’ont pour l’instant pas démontré leur efficacité dans la prévention des lymphocèles [9].
Infection du site opératoire
Une infection du site opératoire survient dans les 30 jours après l’intervention. Il existe différents niveaux : infection superficielle (peau et tissus sous-cutanés) dans la majorité des cas, ou profonde (fascia et muscle). La fréquence est faible, de l’ordre de 3 %, car la chirurgie axillaire est une chirurgie programmée, avec des protocoles préopératoires bien établis. Les facteurs de risque identifiés sont : l’âge > 75 ans, l’état nutritionnel (amaigrissement, obésité), les maladies associées (diabète, déficits immunitaires, insuffisance rénale, etc.), certaines classes de médicaments (corticothérapie prolongée, traitement antibiotique prolongé avant l’intervention).
Les traitements préventifs sont le respect des protocoles préopératoires, l’identification des facteurs de risque, une antibioprophylaxie peropératoire systématique.
Brides axillaires lymphatiques
Ce sont des cordons sous-cutanés qui apparaissent en postopératoire, occasionnant des douleurs et une limitation des mouvements du membre supérieur en limitant l’abduction à 90°. Ils sont principalement localisés au niveau du creux axillaire, mais peuvent également être localisé dans le sein, et jusqu’au poignet. Peu d’articles traitent de ce symptôme et ainsi les incidences varient de 6 à 50 % [14, 15]. Trois dénominations nous permettent d’identifier les articles relatifs à ce syndrome : la maladie de Mondor, les thromboses lymphatiques superficielles visualisables en échographie [16], et l’axillary web syndrome. La physiopathologie n’est pas élucidée : phénomènes thrombotiques obstruant les veines et/ou les lymphatiques, ou rétraction aponévrotique en rapport avec l’incision chirurgicale de l’aponévrose axillo-clavipectorale se répercutant sur les aponévroses thoraciques superficielles et les fascias du bras. Une prise en charge kinésithérapique peut être proposée. Celle-ci consiste en des manoeuvres d’étirement axial associées à un drainage lymphatique manuel linéaire avec la pulpe des doigts [17].
Différentes prises en charge médicamenteuses ont été testées, telles que les anti-inflammatoires, les anticoagulants, l’aspirine, mais sans succès.
Complications à distance : le lymphoedème du membre supérieur
Le lymphoedème est une augmentation du volume du membre supérieur par insuffisance du retour lymphatique. Il est souvent diagnostiqué au début par la patiente elle-même, celle-ci se plaignant d’une sensation de lourdeur, de pesanteur du bras. Il peut être objectivé à ce stade par une difficulté à réaliser un pli cutané sur la face interne du bras. C’est le stade I de la classification de Brunner est la suivante.
La classification des stades cliniques selon Brunner est la suivante :
Stade I : lymphoedème infraclinique ;
Stade II : lymphoedème clinique partiellement réversible à l’élévation du membre supérieur ;
Stade IIIA : lymphoedème clinique irréversible mais amélioré par le repos ;
Stade IIIB : lymphoedème clinique irréversible spontanément ;
Stade IV : lymphoedème clinique éléphantiasique avec sclérose cutanée et gêne fonctionnelle.
Le lymphoedème du membre supérieur engendre une morbidité chronique qui altère la qualité de vie des patientes opérées d’un cancer du sein. Il concerne 15 à 40 % des patientes ayant un curage axillaire [18, 19].
Traitements préventifs
Prévention primaire Les traitements préventifs du lymphœdème dont l’efficacité est prouvée sont :
La désescalade chirurgicale chez les patientes N0 grâce à la mise au point et à la validation de la technique du GS dès les années 2000 [9, 18, 20–22]. Le GS a permis de réduire des deux tiers la survenue d’un lymphoedème [9] ;
La lutte contre les facteurs de risque (prise de poids, obésité) [18, 19] ;
Une activité physique adaptée [18, 19].
Prévention secondaire Trente pour cent des patientes opérées d’un cancer du sein ne peuvent pas bénéficier de la technique du GS et auront un curage axillaire. Les indications de curage axillaire sont les cancers du sein multifocaux, les patientes opérées après chimiothérapie néoadjuvante, les échecs de la technique du GS, les patientes ayant un GS métastatique. C’est pour ce groupe de patientes à risque de lymphoedème qu’il est indispensable de réaliser des études prospectives multicentriques sur le dépistage et la prise en charge précoces (éducation et rééducation des patientes) [23, 24].
En France, il n’y a pas de dépistage précoce systématique, ni d’harmonisation dans le traitement des lymphœdèmes de nos patientes. La bio-impédancemétrie est actuellement validée comme outil diagnostique de lymphoedème préclinique [25, 26]. Ces études portant sur la bio-impédancemétrie ont permis d’établir un score dérivé du ratio des différences de liquide extracellulaire entre le bras à risque et le bras controlatéral. Un diagnostic précoce préclinique de lymphœdème a été mis en évidence par un essai prospectif [26] qui a suivi l’évolution des patientes traitées pour cancer du sein à partir de la mesure de base préopératoire. Les patientes ont été surveillées tous les 2 mois pendant 2 ans suivant la chirurgie par la technique BIS® en rapportant le ratio d’impédance du bras à risque au membre controlatéral. Chaque mesure a été comparée au ratio préchirurgical et une augmentation de plus de 3 déviations standard a été définie comme prédictive d’un lymphoedème. Le ratio BIS® a été comparé aux pratiques courantes : bras symptomatique « lourd » et analyse volumétrique utilisant les mesures enregistrées. Il a été démontré que le diagnostic de lymphoedème pouvait être diagnostiqué 10 mois avant, par rapport aux pratiques courantes ; avec une moyenne de 4 mois sur la totalité de la cohorte.
Le manchon de compression prescrit lors du diagnostic d’un lymphoedème préclinique pourrait améliorer le traitement du lymphoedème [27] ; des études prospectives multicentriques randomisées sont nécessaires pour en prouver l’efficacité.
Une étude récente positionne l’activité physique adaptée associée à des conseils hygiéno-diététiques dès la phase postopératoire comme thérapie efficace pour diminuer le risque de lymphoedème.
Traitement curatif
En cas de lymphœdème clinique et symptomatique du membre supérieur, il est nécessaire d’entreprendre une prise en charge kinésithérapique par drainage lymphatique manuel (DM) quotidien et bandage personnalisé, avec des exercices sous bandage et des soins cutanés ; c’est la phase d’attaque [28]. Ce traitement se réalise en ambulatoire ou en hospitalisation. La phase d’entretien permet de maintenir le volume obtenu, nécessitant le port diurne d’une compression médicale élastique, confectionnée sur mesure, et ponctuellement des autobandages si nécessaire.
Les séances de (DM) et leur fréquence dépendent de l’évolution du lymphoedème et de l’implication de la patiente. Ces techniques sont hétérogènes et non codifiées d’un praticien à l’autre ; leur efficacité n’est pas démontrée [19].
Les reconstructions chirurgicales du sein semblent améliorer un lymphoedème existant quand la reconstruction se fait secondairement [29, 30]. Des études prospectives sont nécessaires pour évaluer les différents types de reconstruction et leur délai idéal (immédiat ou secondaire).
Des conseils d’hygiène sont nécessaires pour éviter les épisodes d’érysipèle. Les règles hygiéno-diététiques doivent être mises en place en cas de surpoids ou de prise de poids survenue après le diagnostic.
Effets des autres traitements sur le système lymphatique
La radiothérapie axillaire est indiquée en cas d’atteinte ganglionnaire massive (plus de la moitié des ganglions prélevés) ; elle majore le risque de lymphoedème (60 %) [31].
La chimiothérapie néoadjuvante ou adjuvante à base de taxane est actuellement le traitement standard. Les taxanes ont une influence sur les oedèmes et peuvent majorer le risque de lymphoedème après curage axillaire [32].
La thérapie ciblée, telle que le trastuzumab (Herceptine®), indiquée dans les cancers infiltrants du sein surexprimant l’HER2, n’a pas d’incidence sur le système lymphatique.
L’hormonothérapie est indiquée en cas de cancer infiltrant exprimant les récepteurs aux estrogènes chez les femmes non ménopausées ou ménopausées. Elle est généralement débutée à l’issue des traitements pour une période de 5 ans. L’hormonothérapie n’a pas d’incidence sur le système lymphatique, mais peut accentuer des douleurs articulaires, notamment les molécules de l famille des anti-aromatases.
Conclusion
Le curage axillaire a un impact direct sur le système lymphatique et est source de morbidité pour les patientes : lymphocèle, brides lymphatiques, lymphoedème dégradant leur qualité de vie (douleur, retentissement psychosocial). La radiothérapie axillaire majore les risques de ces complications.
Le chirurgien a mis au point la technique du ganglion sentinelle permettant de diviser par trois le risque de survenue de lymphocèle, douleur, lymphoedème, et améliorant de fait la qualité de vie des patientes.
Actuellement, la prévention secondaire doit être axée sur l’éducation des patientes dès la période postopératoire immédiate en positionnant les kinésithérapeutes (exercices de rééducation, livret d’information éducatif). La prescription de manchon de compression classe 2 à toutes les patientes ayant un curage axillaire en cas de voyage en avion ou d’activité physique régulière sollicitant le membre supérieur doit être évaluée. En cas de surpoids, ou de prise de poids survenue après le traitement d’un cancer du sein, des règles hygiéno-diététiques doivent être délivrées aux patientes.
La prévention secondaire doit également reposer sur le dépistage précoce du lymphoedème par de nouvelles méthodes diagnostiques simples et reproductibles, telle la bio-impédancemétrie, positionnant le kinésithérapeute dès la prise en charge initiale du cancer du sein.
La prise en charge pluriprofessionnelle dès le diagnostic initial de cancer du sein nous permettra d’améliorer la qualité de vie de nos patientes dans l’après-cancer. Les professionnels de santé concernés dès la phase initiale sont les chirurgiens, les kinésithérapeutes et les diététiciennes. Les approches éducationnelles et proactives [33] dès l’indication d’un curage axillaire semblent être les pistes d’avenir pour limiter le risque d’apparition d’un lymphoedème du membre supérieur.
Références I
En savoir plus
Halsted WS. Swelling of arm after operations for cancer of the breast – Elephantiasica Chirurgica – its cause and prevention. Bull Johns Hopkin Hospital 1921 ; 32 : 209.
Kinmonth JB. The lymphatics. Diseases, lymphography and surgery. Baltimore: Arnold ; 1972.
Ferrandez JC, Laroche JP, Serin D, et al. Aspects lymphoscintigraphiques de l’efficacité du drainage lymphatique manuel. J Mal Vasc 1996 ; 21(5) : 283–9.
Di Sipio T, Rye S, Hayes S. Incidence of unilateral lymphoedema after breast cancer : a systematic review and meta analysis. Lancet Oncol 2013 ; 14 : 500–15.
Leung G, Baggott C, West C, et al. Cytokine candidate genes predict the development of secondary lymphedema following breast cancer surgery. Lymphat Res Biol 2014 ; 12(1) : 10–22.
Guides de pratique clinique pour la prise en charge et le traitement du cancer du sein. Document de concertation canadien. 9 mai 2005 Révision du.
Armer JM, Stewart BR. Post breast cancer lymphedema : incidence increases from 12 to 30 to 60 months. Lymphology 2010 ; 43 : 118–27.
Ferrandez JC, Serin D, Bouges S. Fréquence du lymphoedème du membre supérieur aprés traitement du cancer du sein. Facteurs de risque. À propos de 683 observations. Bull Cancer 199 83 : 989–95.
Références II
En savoir plus
https://www.cepidc.vesinet.inserm.fr/inserm/html/pages/informations_cepidc_fr.htm
Belot A, Grosclaude P, Bossard N, et al. Cancer incidence and mortality in France over the period 1980-2005. Rev Epidemiol Sante Publique 2008 ; 56(3) : 159–75.
Silverstein MJ, Skinner KA, Lomis TJ. Predicting axillary nodal positivity in 2282 patients with breast carcinoma. World J Surg 2001 ; 25 : 767–72.
Olivotto IA, Jackson JS, Andersen S, et al. Prediction of axillary lymph node involvement of women with invasive breast carcinoma : a multivariate analysis. Cancer 1998 ; 83 : 948–55.
Sleeman JP, Thiele W. Tumor metastasis and the lymphatic vasculature. Int J Cancer 2009 ; 125 : 2747–56.
Van Trappen PO, Pepper MS. Lymphatic dissemination of tumour cells and the formation of micrometastases. Lancet Oncol 2002 ; 3 : 44–52.
Wang Y, Oliver G. Current views on the function of the lymphatic vasculature in health and disease. Genes Dev 2010 ; 24 : 2115–26.
McSherry EA, Donatello S, Hopkins AM, McDonnell S. Molecularbasis of invasion in breast cancer. Cell Mol Life Sci 2007 ; 64 : 3201–18.
Condeelis J, Segall JE. Intravital imaging of cell movement in tumours. Nature Rev Cancer 2003 ; 3 : 921–30.
Paget S. The distribution of secondary growths in cancer of the breast. The Lancet 1889 ; 133(3421) : 571–3.
Ran S, Volk L, Hall K, Flister MJ. Lymphangiogenesis and lymphatic metastasis in breast cancer. Pathophysiology 2010 ; 17 : 229–51.
Schoppmann SF, Fenzl A, Nagy K, et al. VEGFC expressing tumor-associated macrophages in lymph node positive breast cancer : impact on lymphangiogenesis and survival. Surgery 2006 ; 139 : 839–46.
Das S, Skobe M. Lymphatic vessel activation in cancer. Ann N Y Acad Sci 2008 ; 1131 : 235–41.
Karpanen T, Alitalo K. Molecular biology and pathology of lymphangiogenesis. Annu Rev Pathol 2008 ; 3 : 367–97.
Mohammed RA, Green A, El-Shikh S, et al. Prognostic significance of vascular endothelial cell growth factors -A, -C and -D in breast cancer and their relationship with angio- and lymphangiogenesis. Br J Cancer 2007 ; 96 : 1092–100.
Norrmen C, Tammela T, Petrova TV, et al. Biological basis of therapeutic lymphangiogenesis. Circulation 2011 ; 123 : 1335–51.
Koyama Y, Kaneko K, Akazawa K, et al. Vascular endothelial growth factor-C and vascular endothelial growth factor-d messenger RNA expression in breast cancer : association with lymph node metastasis. Clin Breast Cancer 2003 ; 4 : 354–60.
Thiele W, Sleeman JP. Tumor-induced lymphangiogenesis : a target for cancer therapy ? J Biotechnol 2006 ; 124 : 224–41.
Kim KE, Cho CH, Kim HZ, et al. In vivo actions of angiopoietins on quiescent and remodeling blood and lymphatic vessels in mouse airways and skin. Arterioscler Thromb Vasc Biol 2007 ; 27 : 564–70.
Schioppa T, Uranchimeg B, Saccani A, et al. Regulation of the chemokine receptor CXCR4 by hypoxia. J Exp Med 2003 ; 198 : 1391–402.
Cardones AR, Murakami T, Hwang ST. CXCR4 enhances adhesion of B16 tumor cells to endothelial cells in vitro and in vivo via beta(1) integrin. Cancer Res 2003 ; 63 : 6751–7.
Li YM, Pan Y, Wei Y, et al. Upregulation of CXCR4 is essential for HER2-mediated tumor metastasis. Cancer Cell 2004 ; 6 : 459–69.
Muller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis. Nature 2001 ; 410 : 50–6.
Références III
Cosset JM. Side effects of ionizing radiation on healthy tissues and organs at risk. Cancer Radiother 2010 ; 14(4-5) : 228–331.
Stone HB, Coleman CN, Anscher MS, McBride WH. Effects of radiation on normal tissue : consequences and mechanisms. Lancet Oncol 2003 ; 4(9) : 529–36.
Milliat F, Francois A, Tamarat R, Benderitter M. Role of endothelium in radiation-induced normal tissue damages. Ann Cardiol Angeiol (Paris) 2008 ; 57(3) : 139–48.
Girinsky T. Effects of ionizing radiation on the blood vessel wall. J Mal Vasc 2000 ; 25(5) : 321–4.
Witte L, Fuks Z, Haimovitz-Friedman A, et al. Effects of irradiation on the release of growth factors from cultured bovine, porcine, and human endothelial cells. Cancer Res 1989 ; 49(18) : 5066–72.
Erickson VS, Pearson ML, Ganz PA, et al. Arm edema in breast cancer patients. J Natl Cancer Inst 2001 ; 93(2) : 96–111.
Références IV
En savoir plus
Fu MR, Chen CM, Haber JH, et al. The effect of providing information about lymphoedema on the cognitive and symptom outcomes of breast cancer survivors. Ann Surg Oncol 2010 ; 17 : 1847–53.
Sappey C. Anatomie, physiologie, pathologie des vaisseaux lymphatiques. Paris: Adrien Delahaye Librairie Éditeur ; 1874.
Berg JW. The significance of axillary node levels in the study of breast carcinoma. Cancer 1955 ; 8 : 776–8.
Vrdoljak DV, Ramjlak V, Muzina D, et al. Analysis of metastactic involvement of interpectoral (Rotter’s) lymph nodes related to tumor location, size, grade and hormone receptor status in breast cancer. Tumori 2005 ; 91(2) : 177–81.
Grossman F. Uber die axillaren lynphdrusen : Inaugural dissertation. 1896. Berlin.
Rotter J. Zur topographie des Mamma-carcinoma. Arch Klinische Chirurgie 1899 ; 58 : 346–56.
Lumachi F, Brandes AA, Burelli P, et al. Seroma prevention following axillary dissection in patients with breast cancer by using ultrasound scissors : a prospective clinical study. Eur J Surg Oncol 2004 ; 30(5) : 526–30.
Mansel RE, Fallowfield L, Kissin, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer : the ALMANAC Trial. J Natl Cancer Inst 2006 ; 98 : 599–609.
Douay N, Ackerman G, Clément D, et al. Seroma after axillary lymph node dissection in breast cancer. Gynecol Obstet Fertil 2008 ; 36(2) : 130–5.
Andeweg CS, Schriek MJ, Heisterkamp J, et al. Seroma formation in two cohorts after axillary lymph node dissection in breast cancer surgery : does timing of drain removal matter ? Breast J 2011 ; 17(4) : 359–64.
Somers R, Jablon LK, Kaplan MJ, et al. The use of closed suction drainage after lumpectomy and axillary node dissection for breast cancer. A prospective randomized trial. Ann Surg 1992 ; 215(2) : 146–9.
Baas-Vranken Peeters MJ, Kluit AB, MErkus JW, et al. Short term versus long-term postoperative drainage oft he axilla after axillary lymph node dissection. A prospective randomized study. Breast Cancer Res Teat 2005 ; 93(3) : 271–5.
Siegel BM, Mayzel KA, Love SM. Level I, and II axillary dissection in the treatment of early-stage breast cancer. An analysis of 259 consecutive patients. Arch Surg 1990 ; 125(9) : 1144–7.
Moskowicz AH, Anderson BO, Yeung RS, et al. Axillary web syndrome after axillary dissection. Am J Surg 2001 ; 181(5) : 434–9.
Torres Lacomba M, Mayoral del Moral O, Coperias Zazo JL, et al. Axillary web syndrome after axillary dissection in breast cancer : a prospective study. Breast Cancer Res Treat 2009 ; 117 : 625–30.
Ferrandez JC, Doyer M, Serin D, et al. Thromboses lymphatiques superficielles. In: Petiot S, Hérisson C, Pélisser J, editors. Cancer du sein traité et médecine de rééducation. Paris: Elsevier Masson ; 2007. p. 119–28.
Ferrandez JC, Serin D. Rééducation et cancer du sein. Paris : Elsevier Masson ; 2006.
Disipio T, Rye S, Newman B, et al. Incidence of unilateral arm lymphedema after breast cancer : a systematic review and metaanalysis. Lancet Oncol 2013 ; 14(6) : 500–15.
Ed Paskett, Dean J, Oliveri J, et al. Cancer-related lymphedema risk factors, diagnosis, treatment, and impact : a review. J Clin Oncol 2012 ; 30 : 3726–33.
Land SR, Kopec JA, Julian T, et al. Patiente-reported outcomes in sentinel-node negative adjuvant breast cancer patients receiving sentinel-node biopsy or axillary dissection : National Surgical Adjuvant Breast and Bowel Project Phase III Protocol B-32. J Clin Oncol 2010 ; 28 : 3929–36.
Krag D, Anderson S, Julian T, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer : overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010 ; 11 : 927–33.
Giuliano A, McCall L, Beitsch P, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases. The American College of Surgeons Oncology Group Z0011 Randomized Trial. Ann Surg 2010 ; 252 : 426–33.
Runowicz CD, Passik SD, Hann D, et al. Patient education pre- and post-treatment. Cancer 1998 ; 83(12-Suppl Am) : 2880–1.
Rockson, Miller LT, Senie R, et al. Diagnosis and management of lymphoedema. Cancer 1998 ; 83(12-Supl Am) : 2882–5.
Ward LC, Dylke E, Phty M, et al. Confirmation of the reference impedance ratios used for assessment of breast cancer-related lymphedema by bioelectrical impedance spectroscopy. Lymphat Res Biol 2011 ; 9 : 47–51.
Cornish BH, Chapman M, Hirst C, et al. Early diagnosis of lymphoedema using multiple frequency bioimpedance. Lymphology 2001 ; 34(1) : 2–11.
Stout Gergish NL, Pfalzer LA, McGarvey C, et al. Preoperative assessment enables the early diagnosis and successful treatment of lymphoedema. Cancer 2008 ; 112(12) : 2809–17.
Ferrandez JC, Bourassin A, Debeauquesne A, et al. Étude prospective ambulatoire multipraticien du lymphoedème du membre supérieur après cancer du sein. À propos de 76 cas. Oncologie 2005 ; 7 : 316–22.
Blanchard M, Arrault M, Vignes S. Positive impact of delayed breast reconstruction on breast-related arm lymphoedema. J Plast Reconstr Aesthet Surg 2012 ; 65(8) : 1060–3.
Card A, Crosby MA, Lindstrom WA, et al. Reduced incidence of BRLO following mastectomy and breast reconstruction versus mastectomy alone. Plast Reconstr Surg 2012.
Kim M, Kim SW, Lee SU, et al. A model to estimate the risk of breast cancer-related lymphedema : combinations of treatment-related factors of the number of dissected axillary nodes, adjuvant chemotherapy, and radiation therapy. Int J Radiat Oncol Biol Phys 2013 ; 86(3) : 498–503.
Vignes S, Arrault M, Dupuy A. Factors associated with increased breast cancer-related lymphoedema volume. Acta Oncol 2007 ; 46(8) : 1136–42.
Fu MR, Axelrod D, Guth AA, et al. Proactive approach to lymphedema risk reduction : a prospective study. Ann Surg Oncol 2014 ; 21(11) : 3481–9.
Pour en savoir plus
En savoir plus
Beaulac SM, McNair LA, Scott TE, et al. Lymphoedema and quality of life in survivors of early-stage breast cancer. Arch Surg 2002 ; 137 : 1253–7.
Karki A, Simonen R, Malkia E, et al. Impairments, activity limitations and participation restrictions 6 and 12 months after breast cancer operation. J Rhabil Med 2005 ; 37 : 180–8.
Passik S, McDonald M. Psychosocial affects of upper extremity lymphoedema in women treated for breast carcinoma. Cancer 1998 ; 83(12- Supl Am) : 2817–20.
Peter JA, Heelan MC. Incidence of breast carcinoma-related lymphoedma. Cancer 1998 ; 83(12-Supl Am) : 2776–81.
Voogd AC, Ververs JM, Vingerhoets AJ, et al. Lymphoedema and reduced shoulder function as indicators of quality of life after axillary lymph node dissection for invasive breast cancer. Br J Surg 2003 ; 90 : 76–81. 0002642472.
Physiothérapie des oedèmes
Ce chapitre est extrait de l’ouvrage Physiothérapie des oedèmes. De la clinique à la pratique coordonné par Jean-Claude Ferrandez, Jean-Yves BouchetSerge Theys, María Torres Lacomba
Références Auteurs
En savoir plus
Ferrandez, Jean-Claude, kinésithérapeute et enseignant à l’Institut national de la kinésithérapie Paris, consultation de lymphologie à l’Institut Sainte-Catherine, Avignon.
Bouchet, Jean-Yves, cadre de santé kinésithérapeute, dirigeant les soins (filière rééducation), CHU de Grenoble.
Theys, Serge, docteur en réadaptation motrice et enseignant à la Haute École Louvain en Hainaut, service d’examens fonctionnels vasculaires, Cliniques universitaires Godinne, Yvoir, Namur (Belgique).
Torres Lacomba, María, kinésithérapeute et docteur en biomédecine, professeur de kinésithérapie à l’Université d’Alcalà, Madrid, Espagne.