Antifongiques azolés : Pharmacologie
France | 27 février 2018
Par Anne Claire Nonnotte
Découvrez le chapitre 14 sur les Antifongiques azolés de l’ouvrage Pharmacologie des anti-infectieux S’ouvre dans une nouvelle fenêtre

Pharmacologie des anti-infectieux
Aurélien Schrapp, Fabien Lamoureux
Points-clés
Les triazolés sont utilisés par voie systémique pour prévenir ou traiter des infections fongiques sévères. Les triazolés présentent une marge thérapeutique étroite, une variabilité interindividuelle importante d’exposition, un risque de toxicité et d’interactions médicamenteuses. Le STP des antifongiques azolés est recommandé pour optimiser ces traitements à partir des concentrations plasmatiques résiduelles.
Rappels physiopathologiques
On estime actuellement que les infections fongiques représentent 5 à 10 % des pathologies infectieuses dans les pays développés. La fréquence des infections par les champignons s’est considérablement accrue au cours des dernières décennies, en particulier du fait de l’évolution continue des pratiques médico-chirurgicales. Cette évolution des pratiques est paradoxalement associée à une augmentation de facteurs de risque d’infections opportunistes, de par leur caractère invasif : interventions chirurgicales, poses de cathéters ou de prothèses, traitements immunosuppresseurs, chimiothérapies anticancéreuses ou antibiothérapies à large spectre. Des facteurs physiopathologiques et environnementaux contribuent également à la survenue d’infections fongiques : âges extrêmes, pathologies du système immunitaire, infections préexistantes, cancers, pathologies hématologiques, dénutrition ou encore travaux de rénovation des infrastructures hospitalières. Les infections fongiques sont de ce fait majoritairement des infections opportunistes , consécutives à un ou plusieurs de ces facteurs de risque. Elles sont une cause majeure de morbidité et de mortalité. Parmi les agents pathogènes les plus fréquents, on retrouve des levures (Candida, Cryptococcus, etc) et des champignons filamenteux (Aspergillus, Mucorales, etc) (figure 14.1).
Figure 14.1
Médicaments existants
Les antifongiques azolés sont des médicaments que l’on peut diviser en deux groupes selon leur structure chimique : les triazolés et les imidazolés (figure 14.2). Malgré un mécanisme d’action pharmacologique commun, ils sont caractérisés par des indications et des paramètres pharmacocinétiques variables. Les triazolés sont à usage systémique et les imidazolés à usage local. L’arrivée des triazolés au cours des trois dernières décennies a considérablement élargi l’arsenal thérapeutique dans le traitement des infections fongiques, longtemps constitué par l’amphotéricine B dont le maniement et la toxicité étaient susceptibles de limiter son utilisation (tableau 14.1).
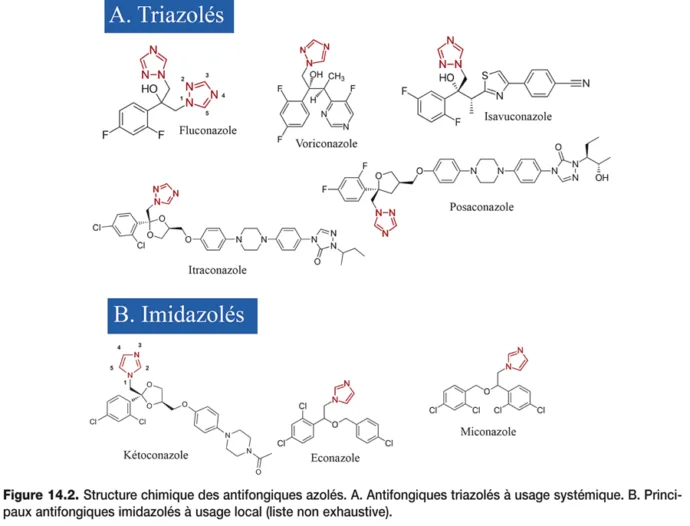
Figure 14.2
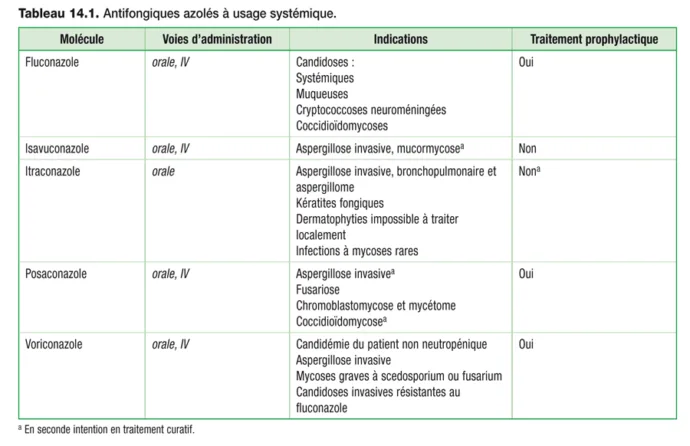
Tableau 14.1
Mécanisme d’action
L’activité thérapeutique des azolés est fongistatique, elle résulte de l’inhibition du CYP450 fongique (CYP51) qui catalyse la déméthylation du 14- α -lanostérol, phase essentielle de la biosynthèse de l’ergostérol fongique ( figure 14.3 ). Cette inhibition entraîne une accumulation de 14- α -méthylstérol associée à une diminution de l’ergostérol dans la membrane cellulaire fongique qui conduit à une inhibition de la croissance fongique. De plus, au niveau cellulaire, l’accumulation de lanostérol altère la perméabilité membranaire, la chaîne respiratoire ainsi que la synthèse de chitine provoquant la mort du champignon. Les azolés ont montré une plus grande sélectivité pour les enzymes du CYP450 fongiques que pour les autres systèmes enzymatiques du CYP450 mammifères. Sur le plan moléculaire, un des atomes d’azote (le N-3 chez les imidazolés et le N-4 chez les triazolés) se lie à l’atome de fer de l’hème situé au niveau du site actif du CYP51 fongique, inhibant de manière irréversible l’activité de ce cytochrome. Certains azolés présentent un mode d’action complémentaire, susceptible d’élargir leur spectre d’action : le voriconazole possède par exemple une activité 24-methylène-dihydrolanostérol déméthylase sur certaines levures/filamenteux et l’itraconazole un pouvoir inhibiteur de la chitine synthase chez les levures . On observe cependant une augmentation croissante d’échecs Figure 14.2 . Structure chimique des antifongiques azolés. A. Antifongiques triazolés à usage systémique. B. Principaux antifongiques imidazolés thérapeutiques associés à la sélection de souches multirésistantes du fait de l’utilisation intensive des fongicides ou fongistatiques en santé humaine ou en agriculture. Le choix du traitement doit se faire selon la nature et la sensibilité de l’agent pathogène, le spectre d’action du médicament, l’état clinique du patient, les comédications susceptibles d’interférer avec l’antifongique. Au cours des infections systémiques impliquant des agents pathogènes rares et/ou en cas d’échec thérapeutique, un antifongigramme est recommandé pour déterminer la CMI du germe. Il sera accompagné de l’identification d’espèce et pourra conduire au choix de la molécule au rapport efficacité/coût le plus favorable.
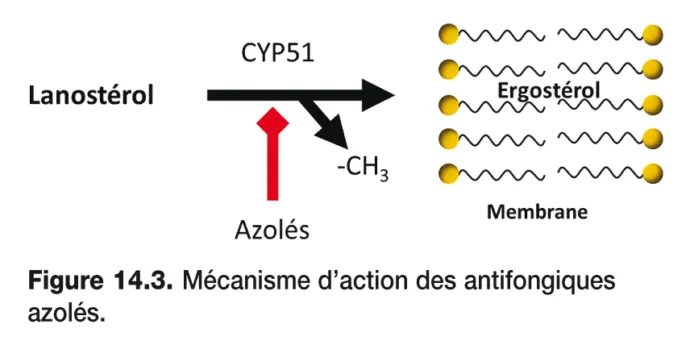
Figure 14.3
Spectres d’activité et indications
Les triazolés sont utilisables par voie systémique dans le traitement curatif et/ou prophylactique des infections fongiques. Le traitement prophylactique est particulièrement utile chez les sujets présentant des facteurs de risque d’infections fongiques (neutropénies, cancer, greffes de cellules souches hématopoïétiques, transplantation d’organe, immunodépression, etc.). Le fluconazole , le voriconazole et le posaconazole sont indiqués dans les traitements prophylactiques et curatifs d’infections fongiques à levures ou filamenteux. L’isavuconazole et l’itraconazole sont indiqués dans les traitements uniquement curatifs des infections fongiques. Les spectres d’effi cacité indicatifs des antifongiques azolés à usage systémique sont présentés dans le tableau 14.2 . Par ailleurs, il existe de nombreux antifongiques imidazolés, ce sont des agents topiques actifs contre une variété de pathogènes dont : Epidermophyton, Microsporum, Trichophyton, Candida ou Malassezia.
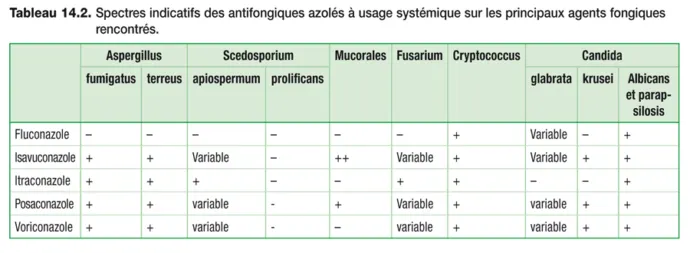
Tableau 14.2
Pharmacocinétique
Les antifongiques azolés à usage systémique possèdent une variabilité pharmacocinétique intraet interindividuelle importante. Leurs propriétés physicochimiques, leur mode d’élimination et leur spectre d’action variable en font une classe thérapeutique hétérogène. Une dose de charge peut être utilisée pour certaines molécules du fait d’une demi-vie d’élimination généralement importante. Les principales caractéristiques pharmacocinétiques des antifongiques azolés à usage systémique sont résumées dans le tableau 14.3 .
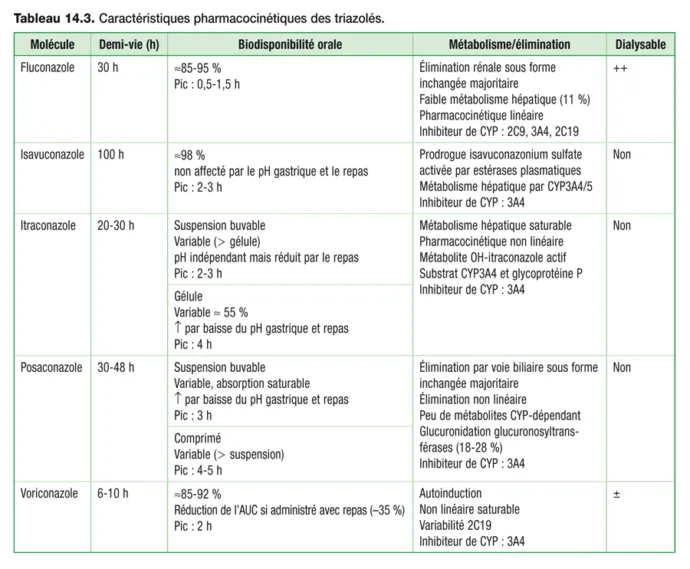
Tableau 14.3
Relations PK/PD et STP
Les antifongiques azolés sont souvent caractérisés par un index thérapeutique étroit et destinés à prévenir ou à traiter des infections graves, susceptibles de menacer le pronostic vital des patients. Ces caractéristiques justifient un suivi thérapeutique pharmacologique systématique de ces médicaments. Parmi les principaux facteurs susceptibles d’influencer l’exposition aux antifongiques azolés, on retrouve notamment l’observance du traitement par le patient, les difficultés d’absorption de certains azolés en fonction des conditions de prise (prise pendant un repas, acidité et contenu lipidique de celui-ci), les comorbidités (notamment insuffisance rénale ou hépatique, troubles digestifs de type diarrhées, mucites, réaction du greffon contre l’hôte [GVH]-intestinales), comédications et variabilité d’expression d’enzymes du métabolisme ou de transporteurs. Les données relatives au suivi thérapeutique des antifongiques azolés sont présentées dans le tableau 14.4 . Le STP des antifongiques azolés repose généralement sur le dosage de la C min à l’équilibre. Le dosage de la concentration au pic peut également être utile pour contrôler l’observance et la capacité d’absorption du traitement par voie orale. Les triazolés sont des antifongiques temps dépendant et leur efficacité optimale est obtenue en maximisant le ratio AUC/CMI, ce ratio étant différent selon chaque agent fongique. Il est à noter que chez les patients présentant des difficultés d’adaptation des doses thérapeutiques de voriconazole, il peut être informatif d’explorer des variants génétiques fréquents du CYP2C19 à la recherche de métaboliseurs lents ou rapides. Enfin, le caractère réfractaire d’un champignon est défi ni par la progression de l’infection ou l’absence d’amélioration après un minimum de sept jours de traitement par un antifongique efficace aux doses thérapeutiques et doit faire penser à réévaluer le traitement.
Contre-indications et interactions médicamenteuses
Les contre-indications majeures des azolés comprennent la grossesse et les associations donnant lieu à des interactions médicamenteuses empruntant les voies de métabolisation des cytochromes hépatiques. Il est indispensable d’évaluer le risque d’interaction avant tout changement de comédication associée aux antifongiques azolés. Les azolés, de par leur mécanisme d’action, sont des inhibiteurs de certains isoformes des cytochromes hépatiques humains (3A4 pour l’itraconazole, l’isavuconazole et le posaconazole ; 3A4, 2C9 et 2C19 pour le voriconazole). Un certain nombre de molécules endogènes sont métabolisées par ces mêmes cytochromes (hormones stéroïdiennes, etc.), cependant, aux doses thérapeutiques, aucun effet clinique notable résultant d’une modification de leur métabolisme n’a été décrit. Par ailleurs, une grande majorité des médicaments emprunte la voie métabolique des CYP450 hépatiques. Cela peut, par conséquent, entraîner des interactions avec les azolés et implique la nécessité d’une surveillance rapprochée de potentiels effets indésirables liés à des traitements concomitants. Les interactions les plus importantes d’un point de vue clinique sont les anti-infectieux de type inhibiteurs de protéases, les alcaloïdes de l’ergot de seigle, les médicaments susceptibles d’allonger le QT (cisapride, pimozide, halofantrine, bépridil), les immunosuppresseurs et les statines. Les puissants inducteurs enzymatiques comme la rifampicine, la carbamazépine, le millepertuis et la phénytoïne doivent être évités dans la mesure du possible. De façon intéressante, les IPP et les anti-H2, qui sont fréquemment associés aux antifongiques azolés, diminuent l’acidité gastrique et sont susceptibles d’entraîner une baisse de la biodisponibilité des azolés, en particulier celle du posaconazole. Parallèlement, plusieurs IPP sont inhibiteurs du CYP2C19 (omeprazole, esomeprazole, lansoprazole), ce qui peut contribuer à diminuer le métabolisme du voriconazole et ainsi augmenter l’exposition au traitement. Enfin, il convient de suivre les concentrations plasmatiques des azolés chez les patients insuffisants hépatiques et d’adapter les doses en conséquence.
Effets indésirables
De manière générale, les triazolés sont associés à un risque de troubles digestifs, de cytolyse hépatique, de réactions allergiques ou de cholestase. Certaines spécialités peuvent contenir des cyclodextrines, un excipient ajouté afin d’augmenter la solubilité du principe actif, (itraconazole, voriconazole, etc.) mais qui aurait été associé à des risques de toxicité rénale. L’itraconazole peut causer des neuropathies périphériques ainsi que des insuffisances cardiaques congestives par effet inotrope négatif. Le voriconazole peut provoquer, et ce de manière concentration- dépendante à partir de résiduelles supérieures à 5-6 mg/l, des troubles cardiaques, neurologiques et visuels de type photopsie, hallucinations, encéphalopathies, en plus d’effets indésirables à plus long terme au niveau cutané de type photosensibilisation ou carcinogenèse. L’isavuconazole qui, en l’état actuel des connaissances, semble posséder une efficacité identique au voriconazole dans le traitement de l’aspergillose invasive, aurait un meilleur profil de tolérance.
Grossesse
Les antifongiques azolés sont considérés comme tératogènes et doivent être évités pendant la grossesse à moins que les bénéfices attendus ne soient estimés supérieurs aux risques encourus par le fœtus, selon la gravité de la pathologie à prévenir ou à traiter.
© 2018 Elsevier Masson SAS
Vous venez de lire le chapitre 14 sur les Antifongiques azolés de l’ouvrage Pharmacologie des anti-infectieux S’ouvre dans une nouvelle fenêtre
Les Auteurs Aurélien Schrapp, laboratoire de pharmacologie et toxicologie, CHU de Rouen, Rouen. Fabien Lamoureux, laboratoire de pharmacologie et toxicologie, CHU de Rouen, Rouen.