Rétine et vitré : Thérapies laser pour les maladies du segment postérieur
11 janvier 2018
Par Monique Remillieux
Principes de base de la photocoagulation
La photocoagulation utilise l’énergie lumineuse pour coaguler les tissus. Une fois l’énergie lumineuse délivrée au tissu cible, elle se transforme en énergie thermique et la température des tissus s’élève au-dessus de 65 °C, ce qui provoque la dénaturation des protéines tissulaires et la nécrose de coagulation.
Les systèmes actuels de laser du segment postérieur couvrent un spectre lumineux de 400 à 700 nm (vert, jaune, rouge) et s’approchent des longueurs d’onde infrarouges (> 700 nm). Les systèmes de délivrance peuvent utiliser une approche transpupillaire avec lampe à fente ou ophtalmoscopie indirecte, l’endophotocoagulation pendant la vitrectomie, ou l’application transsclérale avec une sonde de contact.
L’efficacité de la photocoagulation dépend de la transmission de la lumière à travers les tissus oculaires et de l’absorption de cette lumière par le pigment dans le tissu cible. La lumière est absorbée principalement par les tissus oculaires qui contiennent de la mélanine, de la xanthophylle ou de l’hémoglobine.
La figure 18-1 illustre les spectres d’absorption des pigments clés trouvés dans les tissus oculaires :
la mélanine absorbe efficacement les longueurs d’onde vertes, jaunes, rouges et infrarouges ;
la xanthophylle
maculaire absorbe facilement le bleu mais absorbe peu le jaune et le rouge ;
l’hémoglobine
absorbe facilement le bleu, le vert et le jaune mais n’a qu’une absorption minimale pour les longueurs d’onde rouge.
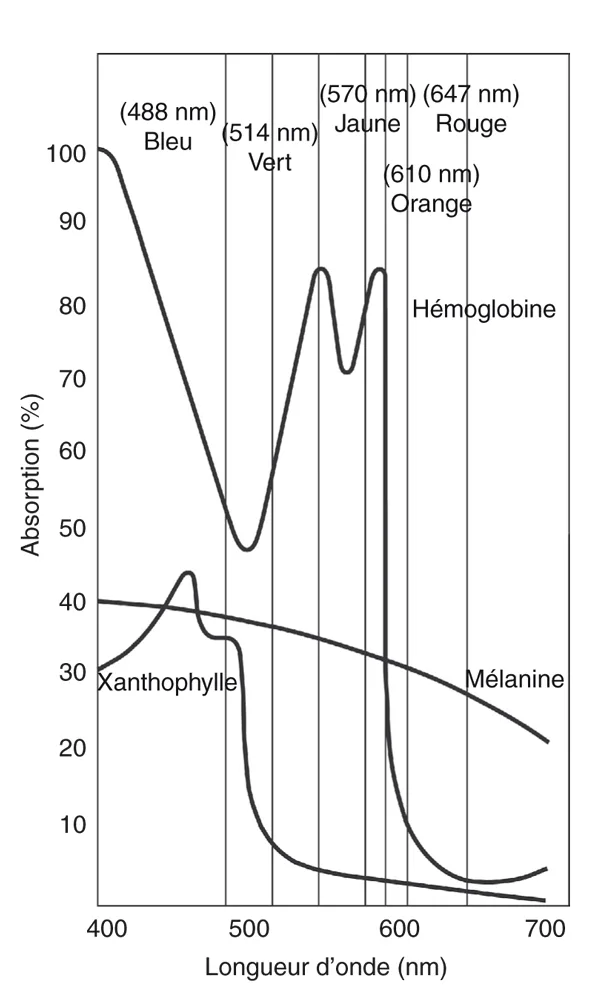
Figure 18-1 Spectre d’absorption de la xanthophylle, de l’hémoglobine et de la mélanine. (D’après Folk JC, Pulido JS. Laser Photocoagulation of the Retina and Choroid. Ophthalmology Monograph 11. San Francisco : American Academy of Ophthalmology ; 1997 : 9.)
Choix de la longueur d’onde du laser
La sélection de la longueur d’onde laser dépend des objectifs spécifiques du traitement et du degré de photocoagulation qui doivent être ciblés sur le tissu particulier tout en épargnant les tissus adjacents sains. La surface (profondeur et diamètre) de la coagulation efficace est directement liée à l’intensité et à la durée de l’irradiation. Pour un ensemble spécifique de paramètres laser (taille du spot, durée et puissance), l’intensité de la brûlure obtenue dépend de la transparence du milieu oculaire et du degré de pigmentation.
Le laser vert produit une lumière bien absorbée par la mélanine et l’hémoglobine mais moins par la xanthophylle. En raison de ces caractéristiques et de l’absence d’effets indésirables des longueurs d’onde courtes (bleues), le laser vert a remplacé le laser bleu-vert pour le traitement des anomalies vasculaires rétiniennes et de la néovascularisation choroïdienne (NVC).
Le laser rouge pénètre à travers les cataractes nucléaires et les hémorragies intravitréennes modérées mieux que les lasers avec d’autres longueurs d’onde. De plus, il est absorbé de façon minimale par la xanthophylle et peut donc être utile dans des traitements à proximité de la fovéa. Le laser rouge provoque des brûlures plus profondes avec un taux plus élevé d’inconfort pour le patient et d’absorption non homogène au niveau de la choroïde. Le laser infrarouge présente des caractéristiques similaires à celles du laser rouge avec une pénétration encore plus profonde des tissus.
Le laser jaune a, parmi ses avantages, une dispersion minimale par la cataracte nucléaire, une faible absorption xanthophylle, et peu de potentiel pour les dommages photochimiques. Il semble être utile pour détruire des structures vasculaires tout en causant des dommages minimes aux zones adjacentes de tissu pigmenté. Ainsi, il peut être utile pour le traitement des lésions néovasculaires rétiniennes et choroïdiennes. Pour les longueurs d’onde laser spécifiques, voir la Section 3 du BCSC, Optique clinique, chapitre 8.
Les effets du laser sur les tissus du segment postérieur comprennent des effets photochimiques et thermiques ainsi que la vaporisation. Les réactions photochimiques peuvent être induites par l’ultraviolet ou la lumière visible qui est absorbé par des molécules tissulaires ou par des molécules d’un médicament photosensibilisant (par exemple vertéporfine), produisant des particules d’oxygène réactif cytotoxiques (par exemple des radicaux libres). L’absorption de l’énergie laser par le pigment entraîne une élévation de la température de 10 °C à 20 °C et une dénaturation de protéine subséquente. La vaporisation est générée par la hausse de la température jusqu’au point d’ébullition, ce qui provoque des micro-explosions, comme cela peut se produire dans des brûlures trop intenses. Pour une discussion plus approfondie des caractéristiques de la lumière laser et des interactions lumière-tissu, voir la Section 3 du BCSC, Optique clinique.
Atebara NH, Thall EH. Principles of lasers. In : Yanoff M, Duker JS, eds. Ophthalmology. 4th ed. Philadelphia : Elsevier/Saunders ; 2014 : 32–37.
Palanker D, Blumenkranz MS. Retinal laser therapy : biophysical basis and applications. In : Ryan SJ, Schachat AP, Wilkinson CP, Hinton DR, Sadda SR, Wiedemann P, eds. Retina. Vol 1. 5th ed. Philadelphia : Elsevier/Saunders ; 2013 : chap 39.
Aspects pratiques de la photocoagulation au laser
Anesthésie
Une anesthésie topique, péribulbaire ou rétrobulbaire peut être nécessaire pour faciliter la procédure laser. Les risques d’injection péribulbaire et rétrobulbaire doivent être pris en compte lors du choix de l’anesthésie.
Lentilles
Deux types de lentilles de contact sont disponibles pour réaliser la photocoagulation à la lampe à fente :
lentilles planoconcaves à puissance négative ;
lentilles de haute puissance.
Les lentilles planoconcaves fournissent une image non inversée avec une résolution supérieure d’une petite surface rétinienne. La plupart des cliniciens préfèrent utiliser ces lentilles pour les traitements maculaires. Les miroirs des lentilles planoconcaves permettent la visualisation et la photocoagulation de la rétine plus périphérique, où la localisation exacte dépend de l’angle du miroir utilisé. Les lentilles planoconcaves fournissent généralement la même taille de point rétinien que celle choisie sur le réglage de lampe à fente.
Les lentilles à haute puissance fournissent une image inversée avec une certaine perte de résolution fine, mais ils offrent un large champ de vision, ce qui facilite un traitement efficace sur une vaste zone. La macula peut être maintenue en vue tandis que la périphérie médiane de la rétine est traitée, ce qui rend ces lentilles idéales pour la photocoagulation panrétinienne. Les lentilles haute puissance fournissent une taille de spot qui est agrandie par rapport à la taille de réglage du laser ; le facteur d’agrandissement dépend de la lentille utilisée (tableau 18-1).
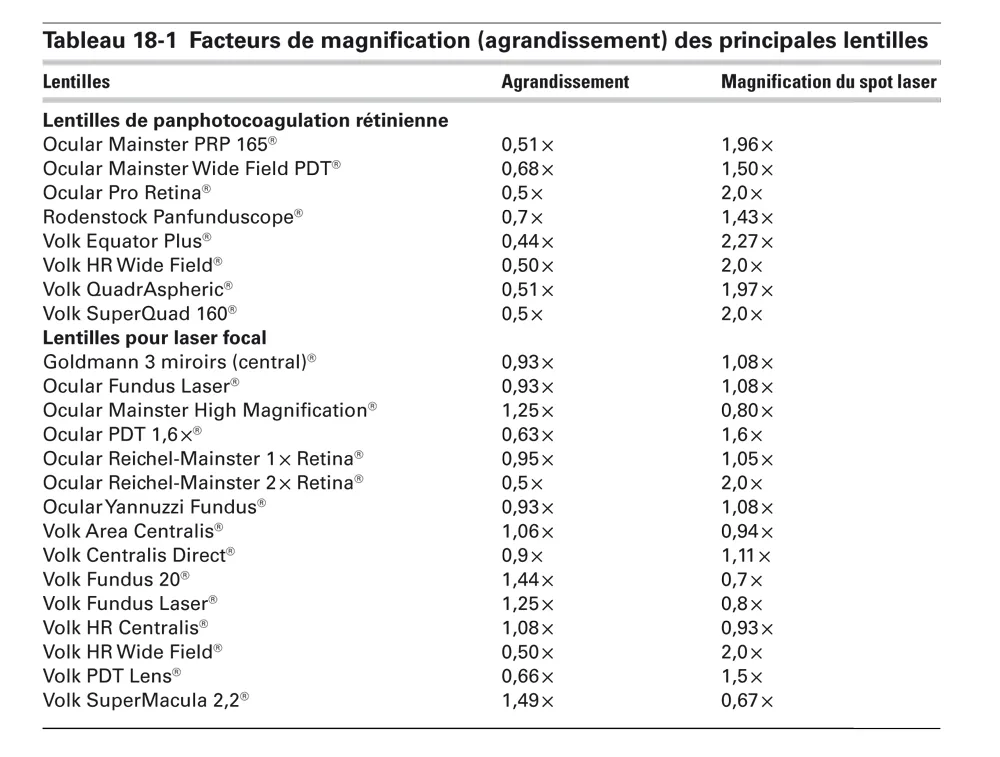
Tableau 18-1 Facteurs de magnification (agrandissement) des principales lentilles
Paramètres et indications
La sélection des paramètres de réglage du laser dépend de l’intention du traitement, de la transparence des milieux oculaires et de la pigmentation du fond de l’œil. En règle générale, les petites tailles de spot nécessitent moins d’énergie que les tailles de spots plus importantes et les expositions de plus longue durée nécessitent moins d’énergie que les expositions de durée plus courte pour obtenir les mêmes effets d’intensité. Les recommandations pour les traitements conventionnels au laser sont fournies ci-après.
Laser maculaire
La photocoagulation laser joue encore un rôle dans la prise en charge de certaines formes d’œdème maculaire, de la néovascularisation choroïdienne (NVC) extrafovéolaire et des anomalies de l’épithélium pigmentaire rétinien (EP) avec des « fuites », comme celles observées dans la choriorétinopathie séreuse centrale. Afin d’éviter de créer des scotomes centraux et une raréfaction capillaire périfovéolaire, le traitement ne doit pas être administré à moins de 500 μm du centre de la fovéa. Le traitement laser pour l’œdème maculaire repose en général sur un spot de petite taille (100 à 200 μm) et une durée d’exposition courte (≤ 0,1 seconde) afin d’obtenir des brûlures petites et moins intenses. Pour l’œdème maculaire diabétique, la thérapie au laser vert ou jaune direct peut être appliquée à tous les microanévrismes situés entre 500 μm et 3000 μm du centre de la macula. Pour des zones de diffusion plus diffuses ou des zones de capillaires de non-perfusion, une grille de faible intensité utilisant le laser vert ou jaune peut être appliquée lorsque les zones de fuite sont à plus de 500 μm du centre de la macula et 500 μm du bord temporal de la papille optique. Une stratégie similaire est utilisée pour traiter l’œdème maculaire secondaire à une occlusion de branche de la veine centrale de la rétine. Si les points de fuite d’une NVC ou de l’EP sont traités, l’objectif est d’obtenir une brûlure plus intense de toute la lésion ou du point de fuite.
Photocoagulation rétinienne périphérique
La photocoagulation rétinienne périphérique peut être réalisée avec une lampe à fente ou un système ophtalmoscopique indirect. Ce dernier système permet moins de contrôle sur la taille précise des taches ou l’intensité des brûlures. Pour la photocoagulation panrétinienne (PPR) ou la rétinopexie au laser, l’objectif est de réaliser des brûlures laser plus intenses et plus importantes. Pour la PPR, la taille du spot laser est typiquement de 200 à 500 μm, et la puissance du laser est ajustée pour obtenir des spots couleur crème. Les spots sont habituellement espacés de la moitié à une largeur de brûlure (voir fig. 5-13) et doivent épargner la macula. Pour le traitement initial, certains praticiens laissent une zone de rétine non traitée, environ 1 à 2 diamètres papillaires autour de la macula et de la tête du nerf optique, alors que d’autres traitent jusqu’aux arcades vasculaires et jusqu’au nerf optique (fig. 18-2).
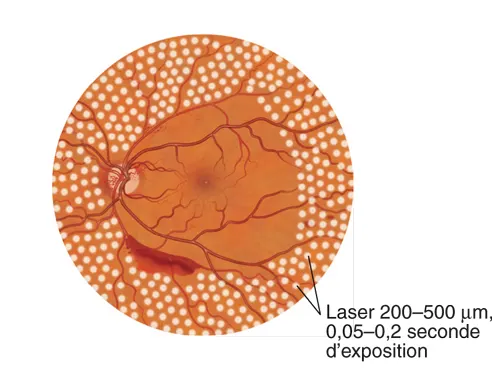
Figure 18-2 Illustration de l’étendue postérieure de photocoagulation panrétinienne complète (traitement périphérique non représenté). (Illustration de Mark Miller.)
Le schéma de traitement initial peut être plus concentré et plus dense en rétine inférieure pour minimiser la perte temporale et inférieure du champ visuel et pour faciliter le retraitement en cas d’hémorragie intravitréenne. Les nerfs ciliaires longs sur les méridiens de 3 et 9 heures doivent être évités, si possible, et tout œdème maculaire coexistant doit être traité préalablement pour éviter son exacerbation après PPR. Typiquement, 1200 à 1400 applications laser de 500 μm de diamètre – l’équivalent de petites brûlures – sont réalisées. La rétinopexie laser permet de créer une adhérence choriorétinienne autour des déchirures de la rétine, ou est utilisée pour la délimitation ou démarcation d’un (petit) décollement de la rétine ; la taille de spot est de 200 à 500 μm dans le but de créer une lésion blanchâtre, mais pas « blanc de neige ». Habituellement, deux à trois rangées de photocoagulation sont considérées comme appropriées pour obtenir l’adhérence souhaitée.
Ablation laser des lésions vasculaires rétiniennes
Les lésions vasculaires sont souvent traitées avec de grands spots (≥ 500 μm), une puissance plus faible et une durée d’exposition plus longue, de sorte que chaque lésion se réchauffe lentement et coagule « de l’intérieur vers l’extérieur ». Les brûlures à haute intensité blanchissent la surface des lésions et, par la suite, le laser à lumière visible ne pénètre pas bien, ce qui rend difficile la réalisation complète du traitement.
Système alternatifs de délivrance laser et stratégies
De nouvelles technologies et de nouveaux concepts ont conduit à de nouveaux systèmes et stratégies de traitement. Parmi les innovations les plus récentes, on trouve des systèmes multispots. Avec ces lasers « à impacts multiples », une seule impulsion sur la pédale provoque une salve d’impacts qui suivent un schéma de tir groupé (pattern) prédéterminé. Les spots ont un temps d’exposition ultra-court (20 à 50 millisecondes), une haute intensité et se succèdent très rapidement, en salve. Cette approche augmente peut-être l’efficacité du traitement, mais ne produit pas un effet équivalent au traitement laser traditionnel à nombre de spots comparable.
Certains systèmes intègrent une superposition d’images rétiniennes en temps réel et un enregistrement couplés à un système de distribution laser. Cette configuration permet une planification assistée par ordinateur et un ciblage des lésions rétiniennes pendant les traitements.
D’autres systèmes permettent une photocoagulation infraliminaire (longueur d’onde à peine visible ou invisible) par laser micropulse (≤ 0,1 milliseconde) capable de confiner la conduction au niveau de l’EP tout en limitant les dommages thermiques aux photorécepteurs et à la choriocapillaire. Ces systèmes ont démontré leur efficacité dans le traitement de l’œdème maculaire diabétique et peuvent potentiellement réduire le nombre et la taille des scotomes. Cependant, l’utilisation d’un laser non visible rend le titrage et la détermination de l’étendue du traitement difficile.
Baumal CR, Ip M, Puliafito CA. Light and laser injury. In : Yanoff M, Duker JS, eds. Ophthalmology. 4th ed. Philadelphia : Saunders/Elsevier ; 2013 : 461–466.
Chappelow AV, Tan K, Waheed NK, Kaiser PK. Panretinal photocoagulation for proliferative diabetic retinopathy : pattern scan laser versus argon laser. Am J Ophthalmol. 2012 ; 153(1) : 137–142.e2.
Folk JC, Pulido JS. Laser Photocoagulation of the Retina and Choroid. Ophthalmology Monograph 11. San Francisco : American Academy of Ophthalmology ; 1997.
Complications de la photocoagulation
Les complications les plus graves de la photocoagulation sont causées par l’utilisation d’une énergie excessive ou une lumière mal dirigée. Parmi les complications pouvant être associées à la photocoagulation, les brûlures cornéennes par inadvertance peuvent conduire à des opacités cornéennes. Le traitement de l’iris peut entraîner un iritis et créer des zones d’atrophie. Des anomalies pupillaires peuvent survenir suite à des dommages thermiques des nerfs ciliaires longs au niveau de l’espace suprachoroïdien ou du sphincter de l’iris. L’absorption par les pigments du cristallin peut créer des brûlures lenticulaires et des opacités. Une neuropathie optique peut se produire lors du traitement direct sur la papille ou près de celle-ci, et des dommages des fibres nerveuses peuvent être secondaires à une absorption intense dans les zones de pigmentation accrue ou d’amincissement rétinien. Les complications choriorétiniennes incluent les brûlures fovéales, les ruptures de la membrane de Bruch, la création de lésions rétiniennes ou choroïdiennes, et les décollements exsudatifs choroïdiens ou rétiniens.
Brûlures accidentelles de la fovéa
Il faut faire très attention à bien identifier la fovéa au moyen de la biomicroscopie ; cette étape peut être facilitée en comparant l’aspect avec des images récentes d’angiographie à la fluorescéine. Un repérage fréquent du centre de la fovéa tout au long de la procédure est utile pour maintenir une bonne orientation. Dans certains cas, le risque de brûlures fovéales peut être réduit en immobilisant le globe avec une anesthésie péribulbaire ou rétrobulbaire, surtout lorsqu’il s’agit d’un traitement juxtafovéolaire.
Rupture de la membrane de Bruch
La petite taille des points, la puissance élevée et la courte durée des applications augmentent le risque de rupture de la membrane de Bruch, qui peut ensuite donner lieu à une hémorragie de la choriocapillaire et au développement de NVC.
Lésions rétiniennes
Une photocoagulation intense peut provoquer des trous rétiniens de pleine épaisseur. De même, un traitement intense peut créer une prolifération fibreuse, des stries et une distorsion fovéale, avec métamorphopsies ou diplopie. Le traitement focal avec des brûlures de faible diamètre et de haute intensité peut provoquer une occlusion vasculaire ou perforer les vaisseaux sanguins, conduisant à une hémorragie prérétinienne ou intravitréenne. De plus, un traitement panrétinien étendu peut induire ou exacerber un œdème, en particulier chez les patients diabétiques.
Lésions choroïdiennes
Le traitement de la NVC peut être compliqué par une hémorragie sous-rétinienne, une ischémie choroïdienne, une NVC supplémentaire ou une anastomose choriorétinienne. Lorsqu’une hémorragie sous-rétinienne active survient pendant le traitement, une pression digitale sur la lentille doit être réalisée immédiatement afin de pouvoir terminer le traitement de la NVC sans être gêné par un obscurcissement des repères anatomiques. Une atrophie progressive de l’EP peut se développer au bord des cicatrices de photocoagulation, et entraîner un élargissement des scotomes. De plus, les déchirures de l’EP peuvent être précipitées par la photocoagulation.
Décollement de la rétine exsudatif et décollement choroïdien
Une photocoagulation étendue et intense peut conduire à un œdème choriorétinien et entraîner un décollement séreux rétinien et un décollement choroïdien (fig. 18-3). Le décollement choroïdien, à son tour, peut engendrer une fermeture de l’angle iridocornéen par une rotation antérieure des corps ciliaires entraînant une élévation de la pression intraoculaire et rarement une anomalie directionnelle de l’humeur aqueuse qui est dirigée vers le vitré. Le pic de réaction survient 1 à 3 jours après le traitement et se résout spontanément en quelques semaines. Les corticoïdes peuvent être utiles pour traiter l’exsudation massive.
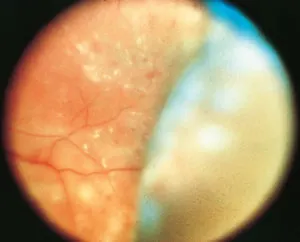
Figure 18-3 Photographie couleur du fond d’oeil montrant un décollement choroïdien qui s’est produit après photocoagulation panrétinienne pour une rétinopathie diabétique. (Remerciements au Dr M. Gilbert Grand.)
Éviter les complications de la photocoagulation au laser
Le repérage et l’évitement de la fovéa au cours du traitement au laser sont primordiaux. La sélection de la bonne longueur d’onde, le choix de la puissance, du temps d’exposition et de la taille du spot sont importants. Le titrage approprié de la puissance du laser et du temps d’exposition peut être nécessaire pour obtenir l’effet tissulaire souhaité. Le fait d’attendre une dilatation pupillaire adéquate peut aider à limiter les dommages iriens. Une explication préopératoire soigneuse de la procédure laser au patient et un positionnement confortable de celui-ci peuvent faciliter la coopération et le maintien de la fixation, et ainsi améliorer la sécurité.
Palanker D, Lavinsky D, Blumenkranz MS, Marcellino G. The impact of pulse duration and burn grade on size of retinal photocoagulation lesion : implications for pattern density. Retina. 2011 ; 31(8) : 1664–1669.
Thermothérapie transpupillaire
La thermothérapie transpupillaire (TTT) agit de manière infraliminaire en élevant légèrement la température choroïdienne, provoquant ainsi un endommagement thermique minimal de l’EP et de la rétine sus-jacente. La TTT est administrée avec un laser infrarouge (810 nm) en utilisant des tailles de faisceaux de 0,8 mm à 3,0 mm, une puissance entre 250 mW et 750 mW et un temps d’exposition de 1 minute. Pour le mélanome choroïdien, la TTT peut être considérée comme un traitement unique pour les tumeurs planes, mais pour les tumeurs plus épaisses, une combinaison de TTT et de radiothérapie externe entraîne une meilleure maîtrise locale des tumeurs que la TTT seule.
Thérapie photodynamique
La thérapie photodynamique (photodynamic therapy [PDT]) utilisant la vertéporfine, un médicament photosensibilisant, est approuvée par la Food and Drug Administration (FDA) pour le traitement de certains types de néovaisseaux choroïdiens (NVC) rétrofovéolaires de la dégénérescence maculaire liée à l’âge ou secondaires à l’histoplasmose oculaire et la myopie. La PDT est de plus en plus abandonnée au profit d’autres traitements plus efficaces devenus disponibles pour prendre en charge une NVC. Cependant, la PDT continue d’être une option précieuse pour la prise en charge de certaines tumeurs oculaires et de la choriorétinopathie séreuse centrale.
La PDT est une procédure en deux étapes :
administration intraveineuse du médicament photosensibilisant qui se localise au niveau de l’endothélium de cellules de vaisseaux présents dans la NVC et les tumeurs ;
activation locale du médicament par une longueur d’onde laser absorbée préférentiellement par le médicament sensibilisant.
L’énergie laser de faible intensité produit une réaction photochimique conduisant à la formation d’espèces réactives à l’oxygène et de radicaux libres. Ces radicaux provoquent des lésions des cellules endothéliales, une adhérence plaquettaire, une thrombose vasculaire et une fermeture du lit capillaire.
Complications de la thérapie photodynamique
Les effets indésirables les plus graves de la PDT sont les réactions de photosensibilité allant de brûlures faibles à modérées de la peau exposée au soleil. De telles brûlures peuvent être évitées en limitant l’exposition au soleil pendant 5 jours après le traitement. Dans un rapport duTreatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group, une perte de vision sévère survenait chez 0,7 % à 2,2 % des patients dans les 7 jours suivant le traitement par PDT des lésions sous-fovéales. De plus, il existe des effets transitoires liés à la perfusion de vertéporfine, avec des douleurs lombaires, thoraciques et au niveau du flanc qui ont été signalées chez 2,0 % à 2,5 % des patients. Afin de minimiser la non-perfusion de la choriocapillaire et l’ischémie, le traitement utilisant la PDT à demi-fluence (énergie de 25 J/cm2, intensité lumineuse de 300 mW/cm2) est devenue plus courante et peut être aussi efficace que la PDT standard.
Copyright © 2015, American Academy of Ophthalmology, All rights reserved. © 2018, Elsevier Masson SAS. Tous droits réservés pour la traduction française.
Vous venez de lire le Chapitre 18 Thérapies laser pour les maladies du segment postérieurde l’ouvrage Rétine et vitré S’ouvre dans une nouvelle fenêtre