Troubles respiratoires obstructifs du sommeil de l’enfant
24 octobre 2016
Par Anne Claire Nonnotte
Découvrez le chapitre 4 de l’ouvrage Syndrome d’apnées-hypopnées obstructives du sommeil de l’enfant (Rapport SFORL 2016) S’ouvre dans une nouvelle fenêtre

Syndrome d’apnées-hypopnées obstructives du sommeil de l’enfant (Rapport SFORL 2016)
Troubles respiratoires obstructifs du sommeil de l'enfant : définitions, pathophysiologie, examen clinique
La description du syndrome d’apnées–hypopnées du sommeil avec enregistrement polysomnographique chez l’enfant remonte à 1975, et avec perturbation de l’EEG à 1982. Depuis, des avancées dans la compréhension du syndrome dit des « troubles respiratoires obstructifs du sommeil » (TROS) ont été faites.
C. Guilleminault, M. Mondain, R. Marianowski
Définition
Au sein des troubles du sommeil de l’enfant incluant les insomnies, les hypersomnies d’origine centrale (non reliées à un trouble circadien, respiratoire ou autre), les troubles du sommeil liés à un trouble du rythme circadien, les parasomnies, les mouvements anormaux, on isole le syndrome d’apnées–hypopnées obstructives du sommeil (SAHOS) qui est un trouble respiratoire.
La prévalence du SAHOS d’après Brockmann et al. [1] est comprise entre 0,7 et 10,3 % des enfants âgés de 2 à 8 ans. Le SAHOS a un impact négatif sur le développement cognitif et cardiovasculaire des enfants.
La classification internationale des troubles du sommeil (International Classification of Sleep Disorders ou ICSD-2) [2] définit une apnée comme une cessation du flux aérien pendant au moins deux cycles respiratoires. Une durée en secondes n’est pas logique chez l’enfant car la fréquence respiratoire varie de 12 par minute chez l’adolescent à plus de 60 par minute chez un nouveau-né). L’absence de mouvement respiratoire caractérise une apnée centrale ; une persistance des mouvements respiratoires une apnée obstructive (ou hypopnée si la diminution du flux aérien se situe en 30 et 90 %).
Les règles du scoring d’une polysomnographie sont rappelées par l’American Academy of Sleep Medecine en 2012 [3]. Chez l’enfant, une apnée obstructive est retenue lorsque le flux aérien est réduit de 90 % ou plus par rapport à la ligne de base (flux aérien analysé par une sonde thermique oronasale ou par la mesure de la pression positive des voies aériennes ou autre type de capteur de flux) et que cette absence de flux respiratoire survient durant un effort respiratoire. Une apnée centrale se définit par une absence de flux aérien en l’absence d’effort respiratoire, d’une durée de plus de 20 secondes (critère unique et suffisant) ou d’une durée inférieure à 20 secondes mais associée à une désaturation de plus de 3 %. Chez l’enfant de moins de 1 an, elle est définie par une diminution de rythme cardiaque à moins de 50 battements par minute pendant au moins 5 secondes ou moins de 60 battements par minute pendant 15 secondes. Une hypopnée se définit par une diminution du flux aérien par rapport à la ligne de base de plus de 30 % et de moins de 90 %, sur une durée d’au moins de deux mouvements respiratoires, en association avec une désaturation d’au moins 3 % et/ou un micro-éveil.
L’enregistrement de la PCO2 artérielle transcutanée permet d’affirmer l’hypoventilation lorsqu’elle est supérieure à 50 mm de mercure pendant plus de 25 % de la durée totale du sommeil.
L’index d’apnées–hypopnées (IAH) correspond au nombre d’apnées obstructives et/ou d’hypopnées par tranche horaire. Il est anormal lorsque cet index est supérieur à 1,5. Classiquement, le SAOS est dit modéré à sévère lorsque l’IAH est supérieur à 5, mais des variations existent entre les articles (par exemple : Mitchell et Kelly en 2007 [4] : SAOS léger entre 2 et 5, modéré entre 5 et 15, et sévère si IAH > 15 ; Moraleda-Cibrián et al. [5] en 2015 : SAOS léger entre 1 et 5, modéré entre 5 et 10, et sévère si IAH > 10). La sévérité du SAOS de l’enfant tient compte de l’IAH, mais surtout des comorbidités (notamment malformation, obésité) ce qui explique cette absence de consensus [6].
Épidémiologie
La pathologie obstructive du sommeil est extrêmement banale chez l’enfant.
Un travail de Lisa Metzler, en 2010 [7], a étudié la prévalence des troubles du sommeil diagnostiqués chez l’enfant en soins primaires (154 957 enfants de 0 à 18 ans). Pour cela, elle a étudié l’équivalent du Programme de Médicalisation des Systèmes d’Information PMSI (à savoir l’International Classification of Diseases 9 ou ICD-9 correspondant aux troubles du sommeil chez l’enfant). La prévalence retrouvée des troubles respiratoires du sommeil était 1,04 % de la population. Corbo [8] rapporte sur 1615 enfants âgés de 6 à 13 ans, 16,3 % d’enfants ronfleurs habituels, 8,5 % d’enfants ronflant lors d’épisodes de rhinopharyngite et 33,3 % de ronfleurs occasionnels.
Hall et al., en 1995 [9], ont étudié 500 dossiers d’enfants de 4 ans. Sur 325 dossiers exploitables, ils ont retrouvé 6,2 % d’enfants ronflant toutes les nuits, 18 % ronflant lors des rhinopharyngites, et des apnées décrites chez 1,5 % des enfants. Il était noté plus de ronflements chez les enfants porteurs de sucette, chez les enfants ayant des parents ayant fait l’objet d’une amygdalectomie ou d’une adénoïdectomie, avec la notion de ronflement plus fréquent en cas de palais étroit.
Une étude de Marcus et al. en 2012 s’est intéressée aux publications traitant du diagnostic et de la prise en charge des SAHOS de l’enfant. Elle retrouve 3166 articles publiés, avec une prévalence du SAHOS allant de 0 à 5,7 %, avec l’obésité comme principal facteur de risque [6].
Dans une méta-analyse [10], un ronflement simple est rapporté chez 7,45 % des enfants, des apnées sont rapportées entre 0,2 à 4 % des cas. En termes d’ethnie, les Afro-Américains ont plus de trouble du sommeil que les Caucasiens. Dans une étude réalisée à Stanford [5], les Asiatiques avaient des SAHOS plus sévères que les Caucasiens. Les garçons sont plus souvent apnéiques après la puberté; avant la puberté, il n’y a pas de différence entre les sexes. Le pic de prévalence se situe entre 2 et 5 ans. Il existe des cas familiaux [2].
Physiopathologie: généralités
Les VAS ont fait l’objet de nombreuses modélisations. La description reste identique sous la forme d’un tube avec une filière nasale rétrécie, un segment pharyngé plus ou moins rétréci et souple sous l’influence d’un tonus actif dilatateur neuromusculaire et d’un tonus passif sténosant lié en grande partie au contenu parapharyngé. Chez l’enfant, la sous-glotte est étroite. Le pharynx est l’élément le plus sujet au collapsus, mais il faut ajouter dans certains cas la valve nasale et la sus-glotte chez l’enfant (figure 4.1).
La loi de Poiseuille dit que le débit d’un liquide ou d’un gaz en flux laminaire à travers un tube dépend de la différence de la pression entre les deux extrémités rigides du tube, du rayon (r4 en dénominateur – une petite diminution du rayon entraîne une grosse répercussion sur le débit) et de la longueur du tube ainsi que de la viscosité. Si le calibre n’est pas régulier, l’effet Venturi s’applique avec une vitesse du flux augmentée au niveau du rétrécissement. Or l’effet Bernouilli dit que la pression diminue lorsque le flux est accéléré, ce qui facilite le collapsus des parois du tube si celles-ci sont souples. C’est le premier élément responsable de la fermeture du pharynx (figure 4.2).
Selon le modèle de Starling, la pression de l’air en amont (partie supérieure du tractus) doit être supérieure à la pression à l’intérieur de la lumière pour avoir un débit d’air. La P critique est la valeur de la pression d’amont pour laquelle le débit inspiratoire devient nul: c’est normalement une valeur négative inférieure à la pression atmosphérique, généralement inférieure à − 10 cm H2O durant le sommeil chez le sujet normal. Elle s’élève lors d’apnées, ce qui explique l’absence de flux inspiratoire malgré la dépression thoracique, cette dernière augmentant le collapsus de façon ascendante.
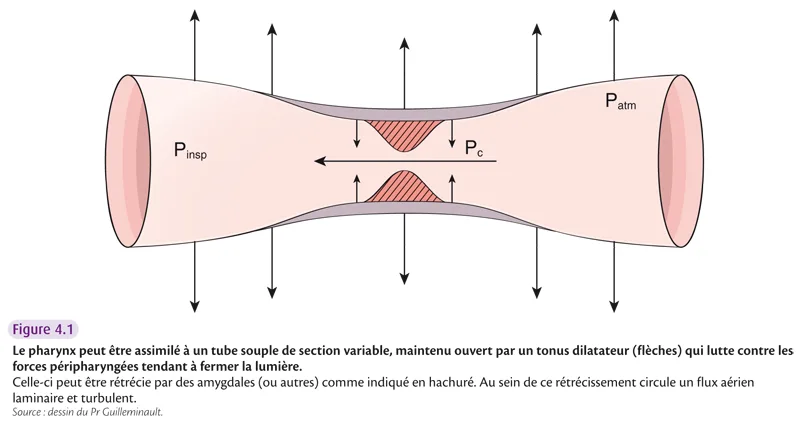
Fig 4 1
À noter que la pression critique est influencée par le sexe et par l’indice de masse corporelle (IMC): les modèles mathématiques expliquent la différence inter-sexe par la différence de longueur du tractus respiratoire chez l’homme et la femme.
Le collapsus peut aussi survenir de façon descendante à partir d’un obstacle nasal ou choanal ou nasopharyngé, mais surtout dans la région où se rencontrent végétations adénoïdes et amygdales palatines (overlap region).
Le siège du collapsus peut donc se faire en de multiples endroits comme démontré en IRM dynamique ou endoscopie du sommeil ou par enregistrement des pressions pharyngées.
L’activité basale, tonique, des muscles dilatateurs, diminue quand le sommeil devient profond, pour atteindre 20 à 30 % de l’activité à l’éveil [11]. Chez un sujet sain, l’activité phasique est globalement maintenue au cours du sommeil, ce qui permet d’assurer la perméabilité des voies aériennes supérieures, sauf en début de sommeil ou en stade REM : cette diminution du tonus dilatateur des VAS est accompagnée d’une diminution de l’activité du diaphragme et des muscles intercostaux, avec une pression inspiratoire qui décroît, permettant le maintien d’une perméabilité des voies aériennes.
Examen clinique
Le contenant pharyngé peut être réduit
Les bases osseuses peuvent être anormales
Les structures osseuses peuvent entraîner un rétrécissement des VAS, que ce soit au niveau des fosses nasales ou au niveau du cavum.
Les anomalies peuvent s’intégrer dans un cadre génétique malformatif présent dès la naissance. C’est le cas des malformations craniofaciales (Crouzon, Apert, autres craniosténoses).
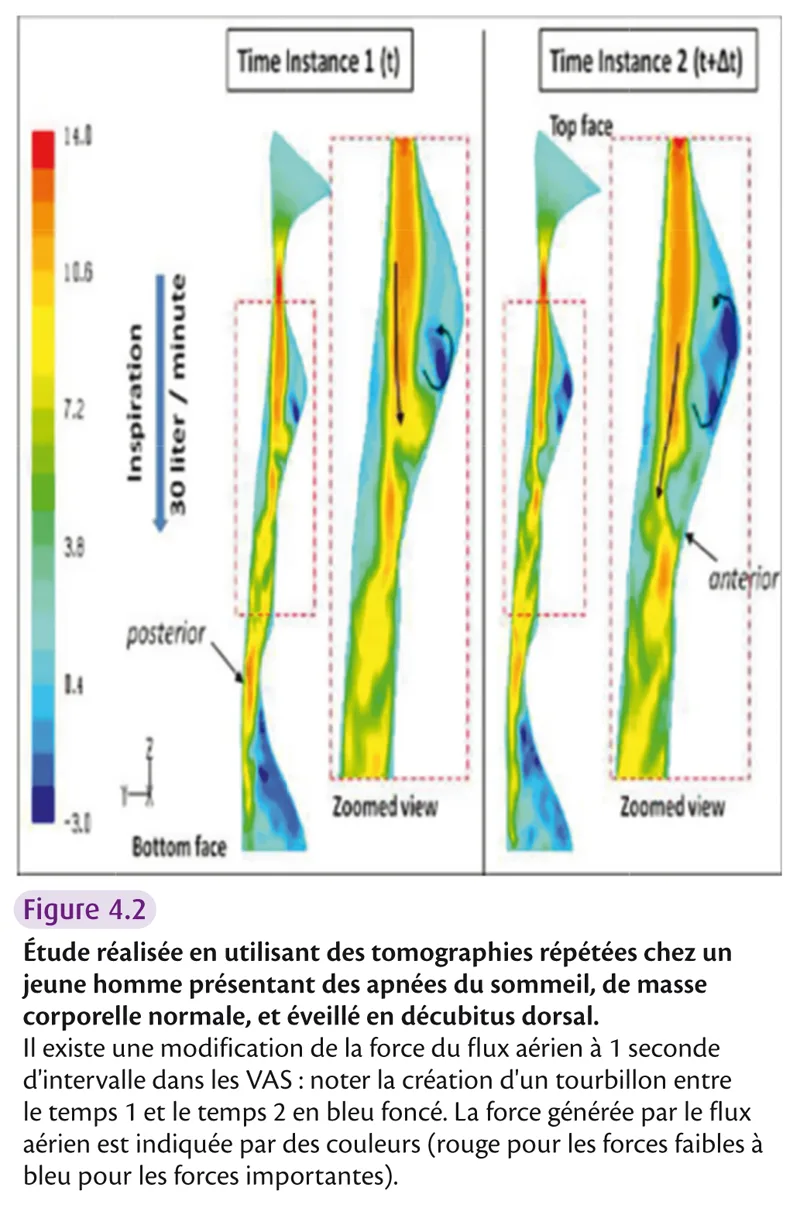
Fig 4 2
Une étude [5] de la fréquence du syndrome d’apnées du sommeil chez les enfants avec une malformation craniofaciale a retrouvé sur 151 enfants symptomatiques, 87 avec un SAHOS dont 24 % avec un SAOS un modéré à sévère.
Le SAHOS est plus fréquent dans les formes syndromiques (33 % dans la population syndromique contre 15 % dans la population non syndromique).
La mandibule peut aussi être responsable d’un rétrécissement des VAS essentiellement par glossoptose. On retrouve dans ce groupe la séquence Pierre Robin, ou les syndromes de Goldenhar par exemple (Franceschetti-Treacher-Collins).
D’autres anomalies des bases osseuses vont s’exprimer lors de la croissance.
Le syndrome de Marfan ou le syndrome d’Ehlers-Danlos sont liés à des mutations touchant le cartilage. Le maxillaire est soumis lors de la croissance à un processus d’ossification enchondrale. La croissance est dès la vie foetale dirigée par la synchondrose (ou centre de croissance) intermaxillaire qui reste active jusqu’à environ 15 ans. Dans ces syndromes, l’anomalie génétique ne permet pas à cette synchondrose de fonctionner normalement et cela entraîne une anomalie de croissance du maxillaire, se traduisant par une voûte du palais anormalement haute et étroite.
La croissance du maxillaire va être influencée par des forces musculaires appliquées essentiellement par la langue avant l’âge de 6 ans. Cette dernière ne s’appuie pas sur le palais chez les enfants respirateurs buccaux exclusifs (déglutition primaire). Une étude de Bakor et al. [12] a comparé la croissance craniofaciale des enfants trachéotomisés, des enfants respirateurs buccaux exclusifs, et des enfants respirant par le nez. Les enfants trachéotomisés et les enfants respirant par le nez ont une largeur maxillaire et mandibulaire identique, et plus large que celle des respirateurs buccaux exclusifs.
Chez le singe Rhésus, une ligature nasale diminuant considérablement l’inspiration nasale, mais pas le flux expiratoire, altère la croissance maxillomandibulaire entraînant une étroitesse nasale et un déplacement mandibulaire, avec un squelette crânien étroit [13]. L’enregistrement de divers muscles orofaciaux dont le géniohyoïdien et le génioglosse montre un changement des décharges normales des fibres musculaires, avec une décharge rythmique intermittente enregistrée. Ces décharges toniques intermittentes disparaissent 6 mois après la levée de la ligature, témoignant d’une modification de la physiologie musculaire participant à l’altération squelettique. Cette altération est définitive contrairement aux modifications de la physiologie musculaire.
Les observations faites sur le singe doivent aussi être mises en parallèle avec les observations faites chez les sujets avec des troubles génétiques musculaires, tels que la dystrophie myotonique [14]. Les sujets ayant une dystrophie myotonique ont une mutation génétique entraînant une contraction anormale des muscles y compris ceux de la face. Ces sujets vont avoir une croissance anormale des os de la face, avec un visage allongé et développement d’un palais haut et étroit. Il existe un SAHOS qui s’aggrave progressivement avec l’âge commençant par des réductions du débit nasal.
L’ankyloglossie est un trouble fréquent qui peut empêcher la langue d’exercer une pression correcte sur le maxillaire. Dans une population étudiée par C. Guilleminault, sur une année, il a été rapporté 35 % d’enfants avec à la fois un SAHOS et un frein lingual court, comparé à une fréquence du frein de langue court dans la population générale entre 2 et 10 %. Sur 200 enfants avec ankyloglossie, 95 % avaient une histoire familiale d’ankyloglossie. Le frein labial supérieur court est moins fréquent et il est souvent vu en association avec le frein lingual court : il limite l’expansion antérieure du maxillaire. Des anomalies dentaires peuvent être associées à un SAHOS de l’enfant ; les anomalies peuvent être acquises (par trouble de la croissance maxillomandibulaire) ou génétique (avec un retentissement sur la croissance osseuse comme dans le syndrome de Pierre-Marie et Sainton).
Le tonus dilatateur du pharynx peut être diminué
Les voies aériennes supérieures du pharynx et du larynx sont maintenues ouvertes par un tonus dilatateur musculaire, avec la commande nerveuse afférente ; seule la trachée n’a pas besoin de force dilatatrice. Normalement, à la fin de l’expiration, la pression dans la lumière pharyngée atteint des valeurs sub-atmosphériques, ce qui entraîne une activation des muscles dilatateurs du nez, du voile du palais (alar nasi, palatoglosse, levator/tensor palatini) et de l’oropharynx et du larynx (génioglosse, géniohyoïdien, sternohyoïdien, sternothyroïdien, cricoaryténoïdien et cricothyroïdien). Ces réponses réflexes et l’activité des muscles respiratoires accessoires sont diminuées lors du sommeil lent et encore plus lors du sommeil paradoxal.
Durant le sommeil, il y a une augmentation de la pression partielle en dioxyde de carbone du sang artériel (PaCO2) de 2 à 5 mmHg et une hypoxie qui stimulent les chémorécepteurs, activant les muscles dilatateurs pharyngés : cette boucle est essentiellement inhibée lors du sommeil paradoxal.
En dehors du sommeil, ce tonus dilatateur peut être impacté par des états neurologiques (infirmité cérébrale) ou musculaire (myopathies, trisomie 21) ou par des médicaments (benzodiazépines) ou toxiques (alcool).
Le contenu pharyngé peut réduire la lumière aérienne
Les formations lymphoïdes peuvent être hypertrophiées
Chez l’enfant, l’hypertrophie des végétations et/ou des amygdales est une cause classique de SAOS. Cette hypertrophie est physiologique entre 1 et 5 ans en raison de la maladie d’adaptation. Avant l’âge de 12 mois, cette hypertrophie est plus rare, mais non exceptionnelle, et doit faire rechercher un reflux gastro-oesophagien (RGO). Les enfants avec un SAHOS ont plus d’hypertrophie des végétations et des amygdales que les enfants non apnéiques. Les enfants de plus de 5 ans ont une protrusion du maxillaire associée à une hypertrophie adénoïdienne, ce qui suggère que l’hypertrophie adénoïdienne entraîne des changements osseux, qui à leur tour augmentent le risque de SAHOS. Plus de 80 % des enfants opérés ont une amélioration du syndrome d’apnée au cours du sommeil après amygdalectomie et adénoïdectomie [15], cette efficacité pouvant être transitoire. Une autre étude a montré que l’adénoïdectomie avec amygdalectomie entraîne une diminution de 75 % de l’index apnées–hypopnées obstructives chez des enfants qui avaient un index apnées–hypopnées obstructives supérieur à 5.
Langue, voile, tumeurs
La présence de ces éléments entraîne un rétrécissement de la voie aérienne susceptible de se majorer en inspiration lors du sommeil.
La langue peut être hypertrophique en raison de son volume : macroglossie d’origine génétique (syndrome de Beckwith-Wiedemann, trisomie 21), macroglossie tumorale sur tumeur bénigne ou maligne ou malformation veinolymphatique, ou hypertrophie des amygdales linguales. La langue peut être le siège d’une infiltration comme toute la muqueuse pharyngée (mucopolysaccharidose, obésité). Sa statique peut être modifiée par une anomalie de ses attaches : attaches anatomiques (rétrognathie) ou attaches dynamiques par anomalie de la musculature (anomalies neuromusculaires ou hypotonie médicamenteuse).
Le voile peut occuper de la place via sa longueur, mais aussi via son infiltration ou son œdème. Le collapsus pharyngé s’initie souvent au niveau vélopharyngé, avec participation des végétations et des amygdales.
Toute tumeur pharyngée diminue le diamètre des voies aériennes supérieures, que ce soit au niveau du cavum (polype antrochoanal, cancer du cavum, tumeurs bénignes du cavum, méningocèle), au niveau du pharynx ou au niveau de la margelle laryngée (kystes laryngés, autres tumeurs du larynx).
Augmentation de l’épaisseur des muqueuses
Les parois du pharynx peuvent être épaissies par une infiltration graisseuse ou par une infiltration dans le cadre d’une maladie de surcharge, ce qui va réduire la lumière et augmenter la souplesse des parois pharyngées.
L’obésité peut être acquise ou d’origine génétique comme dans le syndrome de Prader-Willi. Elle joue via le poids des structures péripharyngées, mais aussi sur l’hypoventilation alvéolaire. La leptine, facteur dérivé des adipocytes, joue un rôle indirect de stimulant respiratoire [16]. Les individus obèses développent une résistance à la leptine conduisant à une dépression respiratoire. Un modèle expérimental suggère que la fragmentation du sommeil, l’hypoxie, l’altération du métabolisme du glucose et la résistance à la leptine dans le SAHOS pourraient conduire à une élévation du seuil sérique de leptine entraînant un dépôt graisseux et une augmentation de l’obésité. Il s’agit donc d’un cercle vicieux.
Une augmentation du contenu veineux en position allongée pourrait modifier la tension de surface et augmenter la résistance des voies aériennes. C’est un des facteurs néfastes du sommeil sur le dos, avec les modifications de la statique thoracique et de la statique linguale. La sévérité du SAHOS a été comparée entre la position sur le dos et la position latérale chez les patients avec un syndrome d’apnées sévère. Les épisodes apnéiques sont plus fréquents et prolongés en décubitus dorsal que latéral [2].
Le syndrome d’apnées du sommeil augmente le RGO par élévation de la dépression endothoracique. Ce RGO participe à l’oedème des muqueuses, aggravant à son tour l’obstruction. C’est un autre cercle vicieux [17].
Troubles de la ventilation nasale
Une augmentation des résistances nasales entraîne un ronflement ou des apnées.
La rhinite allergique peut jouer un rôle dans les obstructions des VAS. Les patients avec une rhinite allergique ont un sommeil de mauvaise qualité comparés aux personnes contrôles, et de nombreuses études ont démontré que la rhinite allergique peut prédisposer ou aggraver le SAOS. Une étude a rapporté que les sujets avec une obstruction nasale liée à l’allergie ont 1,8 fois plus de chances d’avoir un SAOS modéré à sévère. Cette inflammation peut aussi être influencée par les niveaux bas du cortisol la nuit. L’usage d’un corticostéroïde nasal augmente la saturation en oxygène chez les patients porteurs de SAHOS avec rhinite allergique.
Allergies nasales chroniques, anomalies des choanes, anomalies du septum nasal, hypertrophie des cornets inférieurs jouent aussi un rôle dans le passage à la chronicité de troubles respiratoires lors du sommeil. Les troubles de la ventilation nasale entraînent une résistance nasale inappropriée – induisant un syndrome analogue à celui créé expérimentalement chez le singe –, particulièrement néfaste avant 6 ans, période de croissance orofaciale maximale.
Examen clinique de l’enfant apnéique
Entre 0,7 % et 10,3 % des enfants sont atteints de troubles respiratoires pendant leur sommeil, ce qui inclut l’apnée obstructive du sommeil, le syndrome de résistance des voies aériennes supérieures et une respiration superficielle due à l’obésité. Les garçons sont aussi susceptibles que les filles d’être atteints de cette affection, et l’âge de prédilection se situe entre 2 et 5 ans, le même que pour l’hypertrophie des amygdales et des végétations adénoïdes.
Jusqu’à 40 % des enfants dirigés en oto-rhino-laryngologie pour des ronflements souffrent d’apnée du sommeil.
Les objectifs de l’examen clinique sont de déterminer le ou les sites obstructifs, de reconnaître les pathologies associées responsables du SAHOS (malformations, obésité, etc.), de retrouver les facteurs de risque interférant avec la prise en charge thérapeutique (insuffisance respiratoire, âge, etc.), et d’identifier les enfants à risque de complications futures.
Conséquences cliniques du SAHOS
Retard staturo-pondéral
Un trouble respiratoire du sommeil qui demeure non traité peut retarder la croissance de l’enfant, par diminution de la sécrétion d’hormones de croissance.
Santé générale
L’apnée du sommeil non traitée peut contribuer à: l’obésité, un vieillissement prématuré, la léthargie, des problèmes de concentration, l’irritabilité, des problèmes cardiaques, l’hypertension, une diminution de l’efficacité du système immunitaire.
Capacités et développement cognitivo-intellectuel
Le développement de certaines cellules du cerveau ainsi que les capacités intellectuelles et cognitives de l’enfant peuvent être affectés par le manque d’oxygène associé à une apnée du sommeil non traitée.
Fatigue chronique
Les enfants ont besoin de plus de sommeil que les adultes. Comme pour les adultes, les enfants qui ne peuvent avoir une bonne nuit de sommeil seront constamment fatigués, ce qui peut affecter leur concentration et les performances scolaires.
Hyperactivité
Le ronflement et autres troubles respiratoires du sommeil, dont l’apnée du sommeil non traitée, contribuent à l’hyperactivité.
Interrogatoire
On cherchera à obtenir un historique détaillé par l’interrogatoire des parents.
Les symptômes du SAHOS peuvent varier durant la journée. Les symptômes nocturnes incluent ronflement, mouvement paradoxal de la poitrine et/ou de l’abdomen, utilisation des muscles respiratoires accessoires durant l’effort respiratoire, apnée ou pauses respiratoires constatées, tirage, cyanose ou sueurs nocturnes, interruptions du sommeil (parasomnies à type de cauchemars, agitation durant le sommeil), énurésie secondaire.
Les symptômes diurnes incluent l’obstruction nasale, la respiration buccale, les problèmes de comportement (hyperactivité ou hypoactivité), la somnolence diurne excessive, la réapparition de siestes.
L’interrogatoire recherche des facteurs sociaux, environnementaux (pollution, allergènes, tabagisme passif, sommeil des parents et de la fratrie) et pharmacologiques (antihistaminiques, anesthésiques et sédatifs).
Parfois, on pourra s’aider de films ou d’enregistrements sonores réalisés par les parents avec un smartphone.
Examen clinique
L’examen clinique recherche les facteurs prédisposant au SAHOS, notamment l’obstruction nasale (corps étranger, rhinite, polype, sinusite, déviation septale, sténose nasale et atrésie des choanes), l’obstruction oropharyngée (amygdale, voile du palais, macroglossie, micrognathie et rétrognathie), l’obstruction laryngée (palmure laryngée, paralysie de corde vocale et laryngomalacie).
On regarde l’enfant respirer spontanément (respirateur buccal prédominant), et on évalue l’équilibre facial (faciès adénoïdien, face longue).
L’examen physique doit inclure une évaluation globale de l’enfant avec une attention particulière au nez et au pharynx et à l’articulé dentaire. La grosseur des amygdales est évaluée sur une échelle de 0 à 4 (4 représentant des amygdales qui se touchent) (figure 4.1). La classification de Mallampati évalue la participation basilinguale.
L’articulé dentaire est examiné avec soin. On recherche un articulé de classe 2 d’Angle, avec une tendance à la rétrognathie qui est un élément en faveur d’une obstruction rétro-basilinguale.
L’examen fibroscopique précise la taille des végétations adénoïdes, la position du voile, la mobilité laryngée, la taille de la base de langue. Il pourra être réalisé en position assise ou couchée.
L’examen clinique est sensible, mais peu spécifique pour prédire la gravité d’un SAHOS. On pourra s’aider de questionnaires pour sensibiliser l’examen clinique.
De nombreux questionnaires existent évaluant les différentes facettes du SAHOS : qualité de vie, évaluation de la gravité du SAHOS. Leur usage n’est pas systématique. Citons en 2000, Franco et al. qui ont conçu un questionnaire simple pour évaluer la qualité de vie de l’enfant souffrant de syndrome d’apnées du sommeil (SAHOS) (tableau 4.1) [18]. De même, pour évaluer la priorité chirurgicale des enfants souffrant de SAHOS, Nixon et al. (2004) ont créé une échelle de gravité utilisant un moniteur de saturation d’oxygène durant le sommeil à la maison [19].
L’examen clinique, aidé par un questionnaire parental, permet d’approcher le diagnostic de SAHOS et d’en estimer le retentissement. Le diagnostic de sévérité précis passe par l’évaluation du sommeil.
L’évaluation des facteurs de risque prédictifs de complications d’un SAHOS de l’enfant est en cours de développement: ces outils (évaluation de marqueurs de l’inflammation [20], protéomique urinaire [21]) devront faire partie de l’étape clinique dans un futur proche permettant de définir une approche personnalisée du traitement.
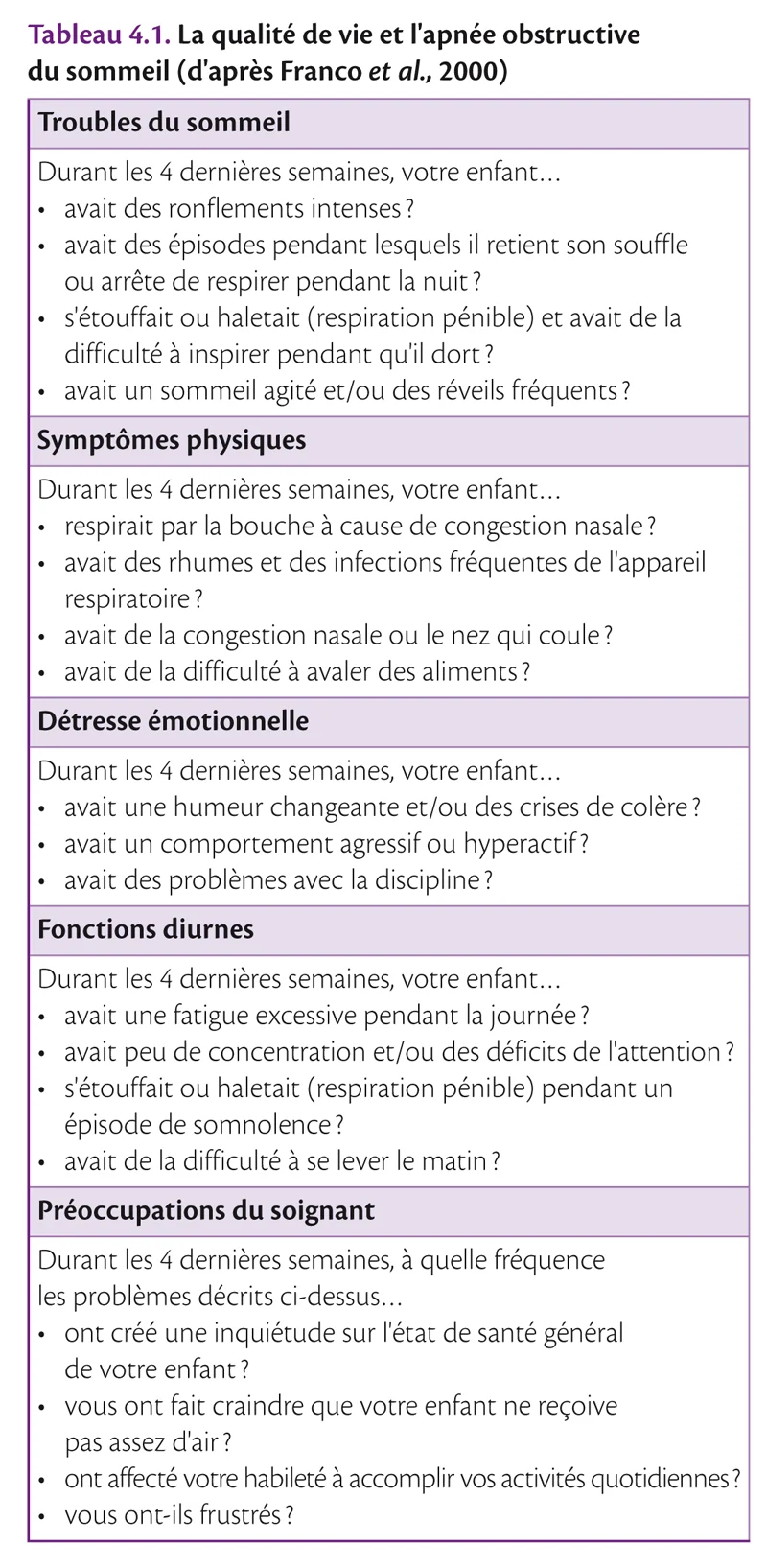
Tableau4.1
Conclusion
Au total, l’examen clinique de l’enfant suspect d’avoir des troubles respiratoires lors du sommeil doit être systématique, car les propositions thérapeutiques seront fondées sur les résultats de cet examen.
Vous venez de lire le chapitre 4 de l’ouvrage Syndrome d’apnées-hypopnées obstructives du sommeil de l’enfant (Rapport SFORL 2016) S’ouvre dans une nouvelle fenêtre Auteurs
En savoir plus
Rémi Marianowski: Professeur des universités-praticien hospitalier, Service d’oto-rhino-laryngologie et de chirurgie cervico-faciale, Pôle Organes des Sens, CHRU de BrestPierre-Jean Monteyrol: ORL, polyclinique de Bordeaux Tondu, Attaché praticien hôpital Pellegrin, Bordeaux
Références
En savoir plus
Brockmann PE, Schaefer C, Poets A, et al. Diagnosis of obstructive sleep apnea in children : a systematic review. Sleep Med Rev 2013 ; 17(5) : 33–40.
Sinha D, Guilleminault C. Sleep disordered breathing in children. Indian J Med Res 2010 ; 131 : 311–20.
Berry RB, Budhiraja R, Gottlieb DJ, et al. Rules for scoring respiratory events in sleep : update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2012 ; 8(5) : 597–619.
Mitchell RB, Kelly J. Outcome of adenotonsillectomy for obstructive sleep apnea in obese and normal-weight children. Otolaryngol Head Neck Surg 2007 ; 137(1) : 43–8.
Moraleda-Cibrián M, Edwards SP, Kasten SJ, et al. Obstructive sleep apnea pretreatment and posttreatment in symptomatic children with congenital craniofacial malformations. J Clin Sleep Med 2015 ; 11(1) : 37–43.
Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics 2012 ; 130(3) : e714–55.
Meltzer LJ, Johnson C, Crosette J, et al. Prevalence of diagnosed sleep disorders in pediatric primary care practices. Pediatrics 2010 ; 125(6) : e1410–8.
Corbo GM, Fuciarelli F, Foresi A, et al. Snoring in children : association with respiratory symptoms and passive smoking. BMJ 1989 ; 299(6714) : 1491–4.
Hultcrantz E, Löfstrand-Tideström B, Ahlquist-Rastad J. The epidemiology of sleep related breathing disorder in children. Int J Pediatr Otorhinolaryngol 1995 ; 32(Suppl) : S63–6.
Lumeng JC, Chervin RD. Epidemiology of pediatric obstructive sleep apnea. Proc Am Thorac Soc 2008 ; 5(2) : 242–52.
Fogel RB, Malhotra A, White DP. Sleep. 2 : pathophysiology of obstructive sleep apnoea/hypopnoea syndrome. Thorax 2004 ; 59(2) : 159–63.
Bakor SF, Enlow DH, Pontes P, et al. Craniofacial growth variations in nasal-breathing, oral-breathing, and tracheotomized children. Am J Orthod Dentofacial Orthop 2011 ; 140(4) : 486–92.
Gaultier C. Sleep-related breathing disorders. 6. Obstructive sleep apnoea syndrome in infants and children : established facts and unsettled issues. Thorax 1995 ; 50(11) : 1204–10.
Staley RN, Bishara SE, Hanson JW, et al. Craniofacial development in myotonic dystrophy. Cleft Palate Craniofac J 1992 ; 29(5) : 456–62.
Capdevila OS, Kheirandish-Gozal L, Dayyat E, et al. Pediatric Obstructive Sleep Apnea. Proc Am Thorac Soc 2008 Feb 15 ; 5(2) : 274–82.
Basoglu OK, Sarac F, Sarac S, et al. Metabolic syndrome, insulin resistance, fibrinogen, homocysteine, leptin, and C-reactive protein in obese patients with obstructive sleep apnea syndrome. Ann Thorac Med 2011 ; 6(3) : 120–5.
Noronha AC, de Bruin VMS, Nobre e Souza MA, et al. Gastroesophageal reflux and obstructive sleep apnea in childhood. Int J Pediatr Otorhinolaryngol 2009 ; 73(3) : 383–9.
Franco Jr. RA, Rosenfeld RM, Rao M. First place-resident clinical science award 1999. Quality of life for children with obstructive sleep apnea. Otolaryngol Head Neck Surg 2000 ; 123(1 pt.1) : 9–16.
Nixon GM, Kermack AS, Davis GM, et al. Planning adenotonsillectomy in children with obstructive sleep apnea : the role of overnight oximetry. Pediatrics 2004 ; 113(1 pt.1) : 19–25.
Kheirandish-Gozal L, Sans Capdevila O, Tauman R, et al. Plasma C-reactive protein in nonobese children withobstructive sleep apnea before and after adenotonsillectomy. J Clin Sleep Med 2006 ; 2(3) : 301–4.
Sans Capdevila O, Crabtree VM, Kheirandish-Gozal L, et al. Increased morning brain natriuretic peptide levels in children with nocturnal enuresis and sleep-disordered breathing : a communitybased study. Pediatrics 2008 ; 121(5) : 1208–14.